铁催化水的氧化:双金属协作实现O-O化学键的生成
催化水的裂解(2H2O→O2 + 2H2)被认为是生产氢气(H2)的理想反应。水氧化(2H2O → O2 + 4H+ + 4e-)是水裂解的关键半反应和瓶颈,其主要原因在于水氧化反应不仅本身热力学电位高,动力学上还需要克服累积质子耦合电子转移(4H+ + 4e-)并生成O-O键的能垒。因此,有效调控累积质子耦合电子转移(4H+ + 4e-)并理解O-O成键的机制是进行水氧化催化剂设计的基础。
自1982年第一例基于钌金属的分子催化剂“blue dimer”(T. J. Meyer, et al. J. Am. Chem. Soc. 1982, 104, 4029)报道以来, 催化剂中心金属的选择也从最初的贵金属逐渐发展到廉价金属;其中,Fe作为地壳中含量最为丰富(4.75%)的过渡金属也逐渐在水氧化中得到了关注(T. J. Collins, et al. J. Am. Chem. Soc. 2010, 132, 10990; M. Costas, et al. Nat. Chem. 2011, 3, 807)。但是,Fe基分子催化剂的催化活性广泛依赖于其配位模式,部分单核催化剂尽管可以生成高价Fe(V)=O中间体,但却不能与水进一步发生反应。为了认识和理解高价中间体Fe(IV)=O或Fe(V)=O在水氧化催化过程中生成O-O键的规律和机制,清华大学基础分子科学中心章名田副教授团队发展了双核铁的水氧化催化剂,并通过配体的精细调控以及构效关系研究揭示了高价Fe=O中间体生成O-O键的机制:在中间体几何构型允许的情况下,两个Fe(IV)=O之间或者Fe(IV)=O与Fe(V)=O之间可以直接形成O-O键;而孤立的Fe(IV)=O或者Fe(V)=O并不能与水有效的发生进一步的反应生成O-O键。华中科技大学化学系廖荣臻教授通过DFT计算对该O-O成键过程进行了详细的分析。
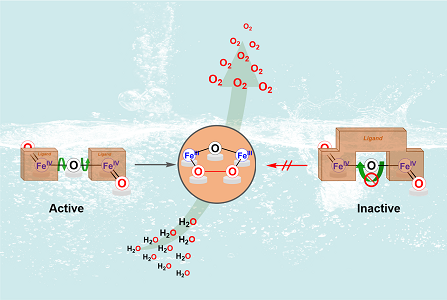
实验结果表明,化合物1-3均可以通过两电子氧化过程形成高价O=(IV)Fe-O-Fe(IV)=O物种,但化合物1和2具有催化水氧化的活性,而结构刚性的化合物3并不能有效地催化水的氧化;并且化合物1的催化效率是化合物2的14倍。
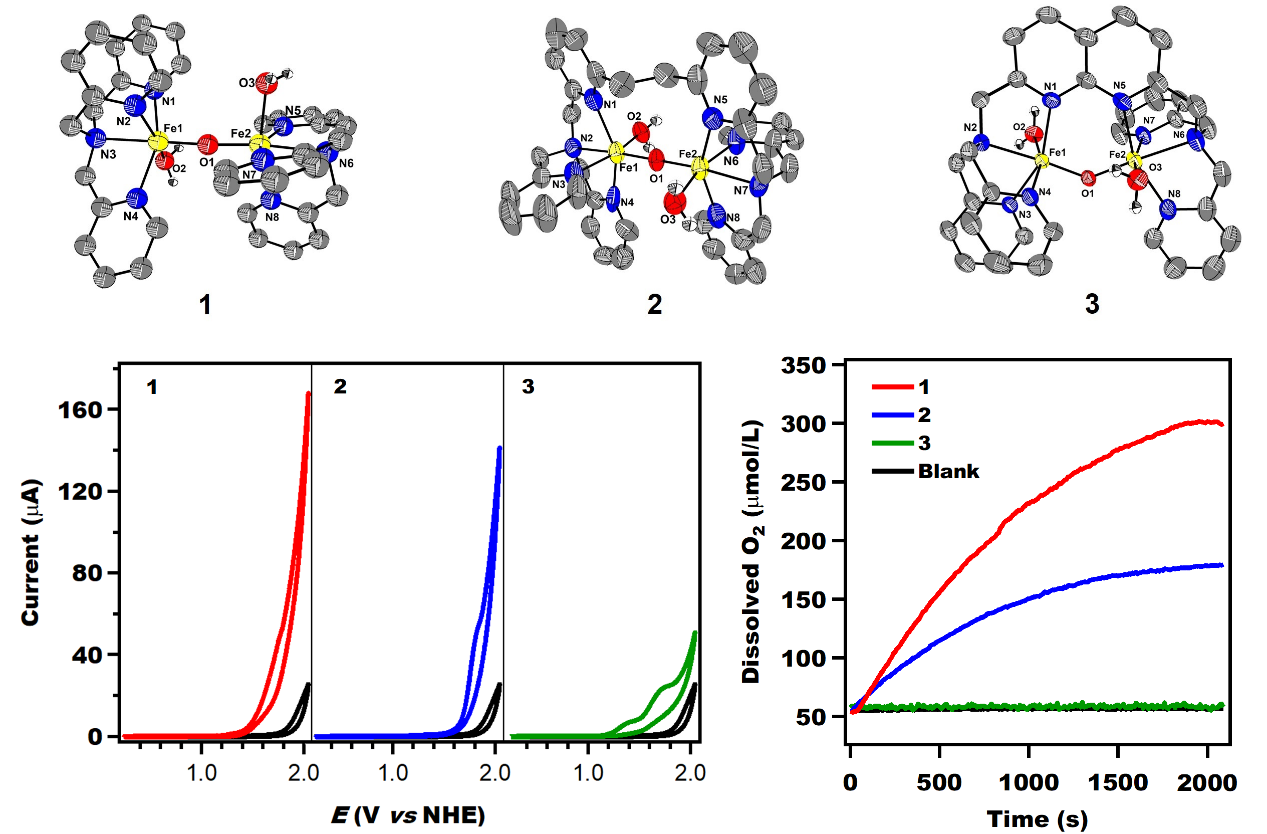
实验和理论计算研究发现,化合物1-3经过质子耦合电子转移(2e + 2H+)氧化后生成的两个Fe(IV)=O具有反式的几何构型(anti-),其中化合物1-2对应的O=(IV)Fe-O-Fe(IV)=O中间体因配体环境灵活的缘故可以实现反式到顺式(anti to syn)的转变,随后两个Fe(IV)=O之间直接相互作用生成O-O键。而化合物3对应的反式O=(IV)Fe-O-Fe(IV)=O由于配体的刚性因素无法发生anti to syn的转变,从而无法通过两个高价Fe=O之间相互耦合生成O-O键,并且两个孤立的Fe(IV)=O或者Fe(V)=O也没有表现出催化水氧化的活性。

该工作提出了双金属协作下的高价Fe=O之间相互耦合是实现铁催化O-O成键的有效途径,并且通过构效关系和机制的研究为新的催化剂的设计提供了思路和基础。
http://论文链接: https://onlinelibrary.wiley.com/doi/10.1002/ange.202100060