亚砜-羟基吡啶配体的设计与应用
清华大学化学系基础分子科学中心焦雷课题组致力于通过机理研究和分子设计发展新催化剂,开发新反应。近期,该课题组报道了受协同金属化-去质子化(CMD)过程启发的亚砜-羟基吡啶配体设计,以及该类配体在区域选择性C(sp2)-H官能团化反应(Chem. Sci. 2020, 11, 11942)和立体选择性C(sp3)-H官能团化反应(Angew. Chem. Int. Ed. 2023, 62, e202300854)中的应用。

图片来源:www.jiaolei.group
过渡金属催化的碳-氢键官能团化反应是构建多官能团化合物和复杂分子后期修饰的理想手段,但由于碳氢键在有机分子中广泛存在,反应的区域及立体选择性控制极具挑战。在C(sp2)-H活化区域选择性调控方面,导向基策略(常用于邻位碳氢键活化,Chem. Soc. Rev. 2018, 47, 6603)与导向模板策略(常用于远程碳氢键活化,Chem. Soc. Rev. 2018, 47, 149)发展较为成熟。此外,配体调控的区域选择性碳氢键活化策略近年来受到越来越多的关注,被认为是解决该问题的理想手段,该领域的代表性成果在二价钯催化中有集中体现(参见余金权,Itami, Stahl, Sanford, Carrow等课题组的工作)。
焦雷课题组经过大量的文献调研,发现在大多数情况下,碳氢键金属化步骤决定了整个反应的区域选择性,其后的官能团化步骤只是继承了碳氢键金属化步骤中的选择性。基于此,他们设想设计一类具有强配体加速效应的配体,大幅降低碳氢键金属化步骤能量,使官能团化步骤在区域选择性调控方面发挥重要作用。带着这种想法,他们设计合成了新型的亚砜-羟基吡啶(SOHP)配体。羟基吡啶作为碱性基团可以大大促进碳氢键金属化,而亚砜作为配位单元在稳定反应中间体的同时可以促进零价钯的再氧化。
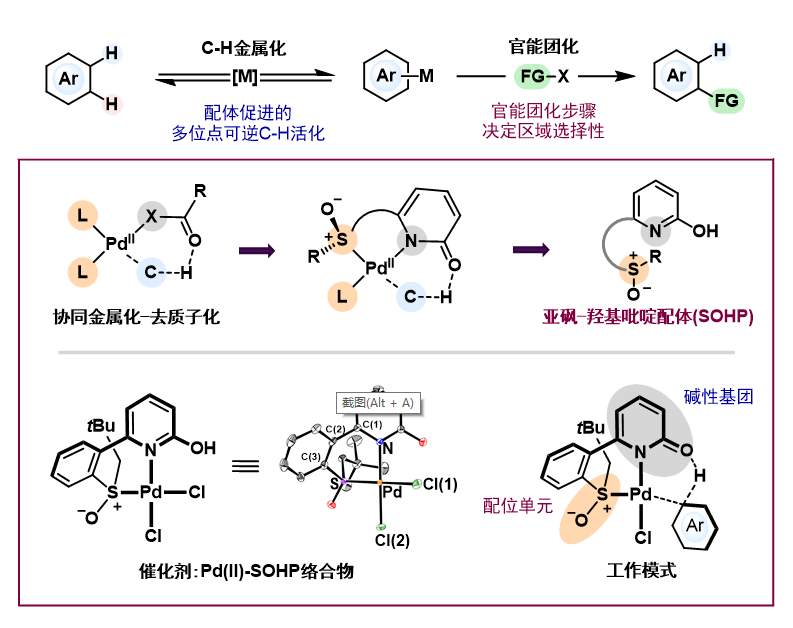
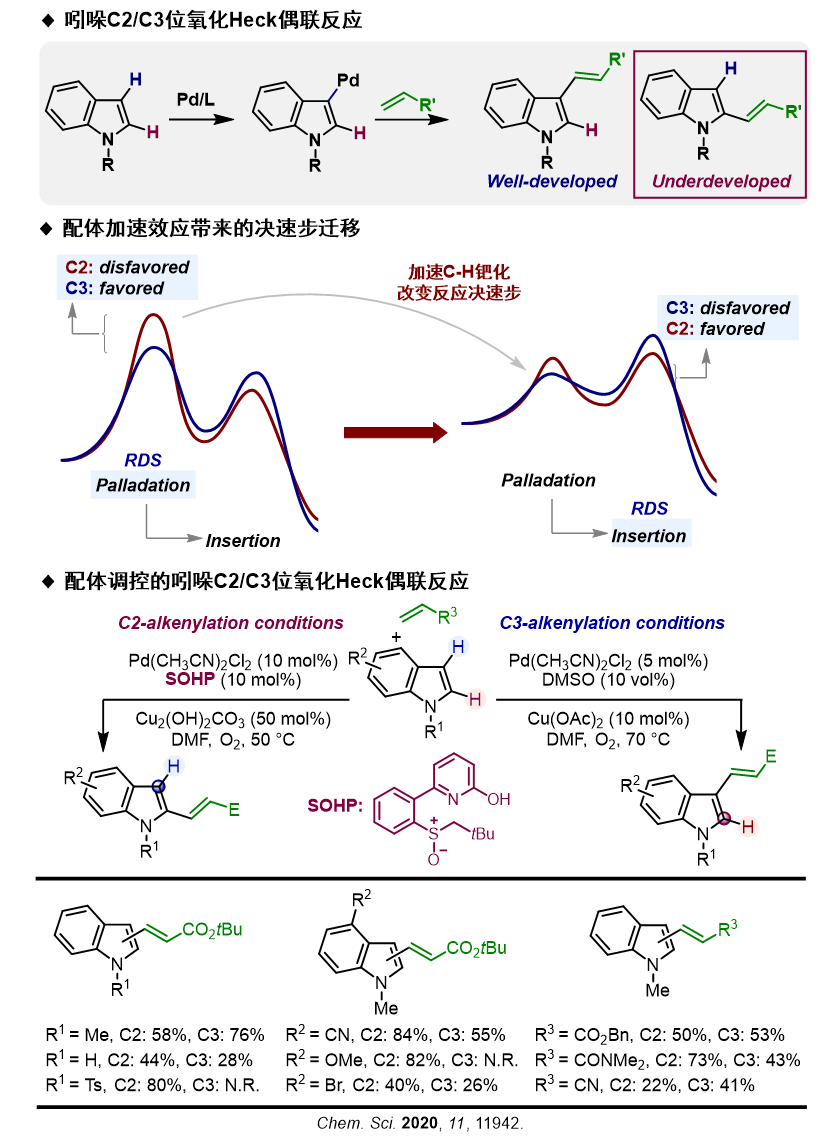
焦雷课题组以Pd(II)催化吲哚氧化Heck反应为模型,探索SOHP配体在反应中的角色。研究表明,SOHP配体能显著降低碳氢活化步骤的反应能垒,使得反应的决速步骤由碳氢活化步骤变为烯烃迁移插入步骤,实现区域选择性反转,选择性生成2-位烯基化产物,成功实现了配体调控反应区域选择性的目标。在随后进行的底物普适性研究中,反应对N-氢/甲基/对苯甲磺酰基吲哚,C3/C4/C5/C6位取代吲哚以及丙烯酸酯/丙烯腈/丙烯酰胺等缺电子烯烃均能较好的兼容,体现出了不错的底物普适性。
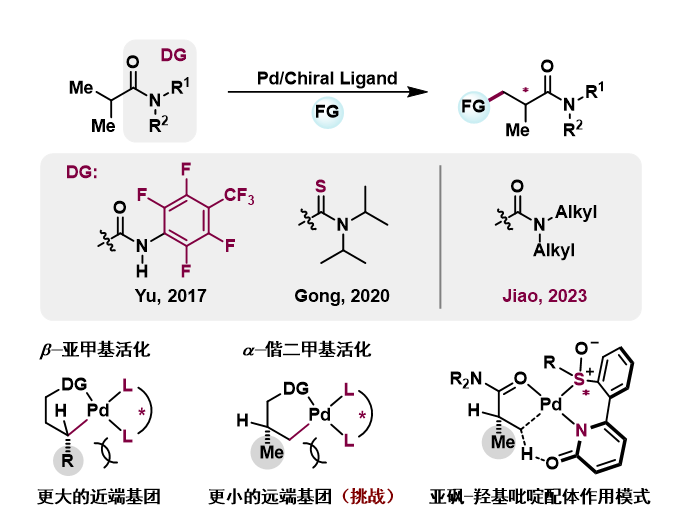
由于SOHP配体在上述烯基化反应中体现出非常强的配体加速效应,且配体中的亚砜结构具备手性特征,焦雷课题组尝试合成手性SOHP配体并应用在立体选择性C(sp3)-H官能团化反应中。
酰胺作为有机分子中广泛存在的官能团,可以作为导向基实现Pd催化的碳氢键官能团化反应。在过去的几十年中,双齿酰胺导向基导向C(sp3)-H官能团化反应日趋成熟,而单齿酰胺导向基由于缺乏双齿酰胺导向基的螯合作用,发展要缓慢的多。目前已实现的单齿酰胺导向基也大多依赖特殊的酰胺结构,如N-全氟苯基酰胺、N-甲氧基酰胺、N-磺酰基酰胺及硫代酰胺等。对于普通烷基酰胺,虽然目前已有零星报道,但都无法实现反应的立体选择性控制。
而焦雷课题组在后续研究Pd(II)/SOHP体系催化活性时发现,在六氟异丙醇/三氟乙醇作为溶剂,芳基碘、一价银盐存在条件下,该体系在N,N-二烷基脂肪酰胺的β-C(sp3)-H芳基化反应中表现出很高的活性。进一步研究发现,Pd(II)/手性SOHP催化体系能很好的实现α-偕二甲基对映选择性活化。相比于β-亚甲基对映选择性活化,α-偕二甲基对映选择性活化更具挑战性(Science 2017, 355, 499)。此前,钯催化α-偕二甲基对映选择性活化仅能在N-全氟苯基酰胺(Science 2017, 355, 499)及硫代酰胺(Angew. Chem. Int. Ed. 2020, 59, 12774)上实现。
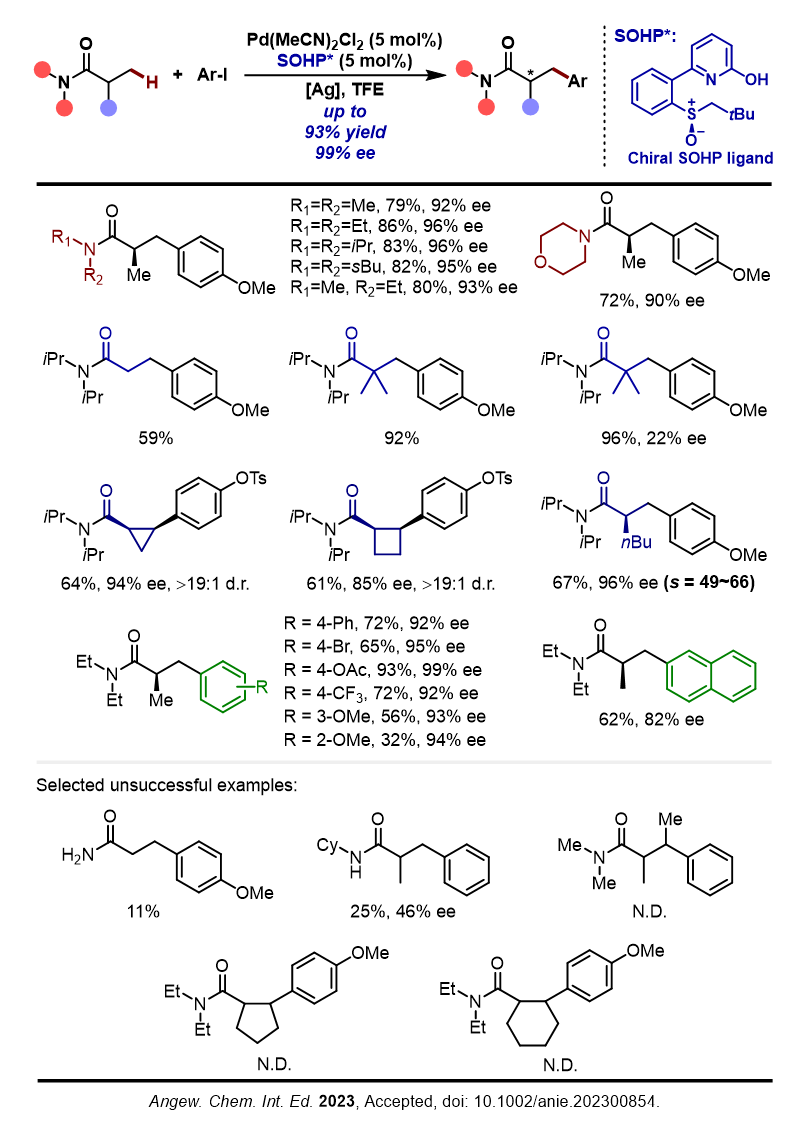
随后,焦雷课题组对反应的底物普适性进行了研究。反应可以兼容不同的链状/环状二级胺模块,且大位阻二级胺能带来反应活性和立体选择性的提升,但对于伯酰胺和仲酰胺则不兼容。在脂肪基模块的兼容性探索中,对于甲基活化,反应除兼容异丁酰胺外,丙酰胺和特戊酰胺类型底物也具有较高的反应活性,但对于特戊酰胺类型底物的立体控制并不理想。特别的,对于外消旋酰胺底物,经由动力学拆分过程,反应能以高对映选择性获得芳基化产物,s因子为49-66。对于亚甲基活化,反应能兼容环丙基酰胺和环丁基酰胺,直链β-亚甲基底物和其他环烷基酰胺则不兼容。反应对不同的芳基碘底物也表现出较好的兼容性,富电子芳基和缺电子芳基都能以高对映选择性生成相应产物,但缺电子芳基的活性更低。反应对芳基部分的位阻较为敏感,对于邻位取代的芳基碘底物,反应仍能以高对映选择性生成相应产物,但产率有明显下降。
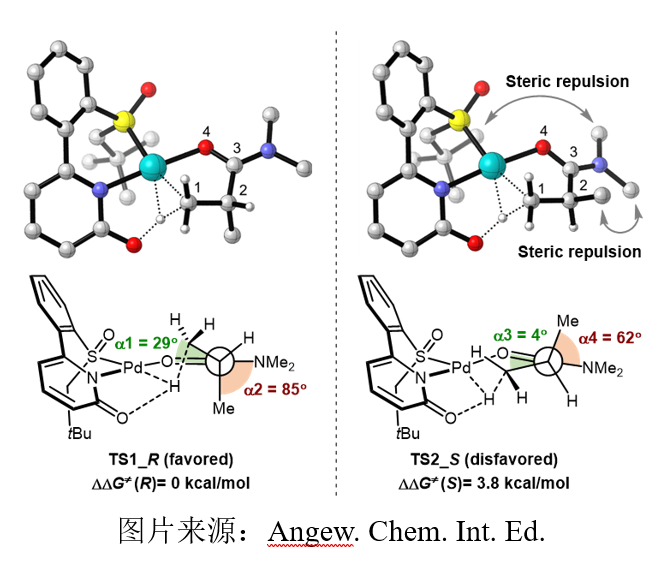
为了获得更多的机理信息,焦雷课题组对反应的机理进行了研究。氘代实验结果表明在反应条件下碳氢活化不可逆,动力学同位素效应实验结果(pKIE = 1.9 , cKIE = 4.9)则表明碳氢活化包含在反应决速步骤中,据上述结果可以推断不可逆的碳氢活化为反应的立体控制步骤。此外,配体的非线性效应实验结果表明反应由单核Pd(II)/SOHP物种催化。根据上述实验结果,焦雷课题组利用DFT理论计算对碳氢活化过渡态进行了研究,揭示了反应实现高效立体控制的原因。计算结果表明,(R)-构型配体诱导(R)-产物生成,这与实验结果一致,而这种选择性主要由立体效应控制。在TS_2S中,以C(α)-羰基碳为轴的纽曼投影式构象接近重叠式,而在TS_1R中,则为交叉式,重叠式构象带来的高扭转张力使得TS_2S更不稳定。非共价相互作用(NCI)分析结果同样揭示了两个过渡态在位阻效应上的显著差异,在TS_2S中,-NMe2基团与酰胺α-Me及配体的-tBu间均存在显著的空间排斥,在TS_1R中则未发现。
综上所述,焦雷课题组通过理性设计,发展了一类具有显著配体加速效应的新型亚砜-羟基吡啶(SOHP)配体。SOHP配体通过显著降低碳氢活化步骤能量,使反应决速步转移到烯烃迁移插入步骤,从而实现了吲哚C2/C3位区域选择性烯基化反应。手性SOHP配体则在显著降低C(sp3)-H活化能的同时,利用手性亚砜结构实现了N,N-二烷基脂肪酰胺芳基化反应的高效对映选择性控制。焦雷课题组在这两项工作中体现出的配体设计思路也为过渡金属催化中配体的理性设计提供了新的视角。
焦雷副教授是以上两篇论文的通讯作者。亚砜-羟基吡啶配体体系开拓及吲哚C2/C3位区域选择性烯基化反应主要由课题组已毕业的王雨洁博士完成,N,N-二烷基脂肪酰胺β-位对映选择性芳基化反应主要由博士生袁晨晖开展,并在博士生王晓霞协助下完成。该工作得到了国家自然科学基金委的大力资助。
论文信息:
https://pubs.rsc.org/en/content/articlelanding/2020/SC/D0SC02246B
Regiocontrol in the oxidative Heck reaction of indole by ligand-enabled switch of the regioselectivity-determining step
Yu-Jie Wang, Chen-Hui Yuan, De-Zhao Chu, Lei Jiao*
Chem. Sci. 2020, 11, 11042-11054. doi: 10.1039/d0sc02246b.
https://onlinelibrary.wiley.com/doi/10.1002/anie.202300854
Ligand-Enabled Palladium(II)-Catalyzed Enantioselective β-C(sp3)-H Arylation of Aliphatic Tertiary Amides
Chen-Hui Yuan, Xiao-Xia Wang, Lei Jiao*
Angew. Chem. Int. Ed. 2023, 62, e202300854. doi: 10.1002/anie.202300854.