二取代喹喔啉类化合物的立体发散式不对称氢化反应
近日,清华大学刘强课题组实现了首例立体发散性不对称氢化反应,可以从相同的双取代喹喔啉底物出发,以良好的立体选择性分别构建具有连续手性中心四氢喹喔啉类化合物的全部四种立体异构体。
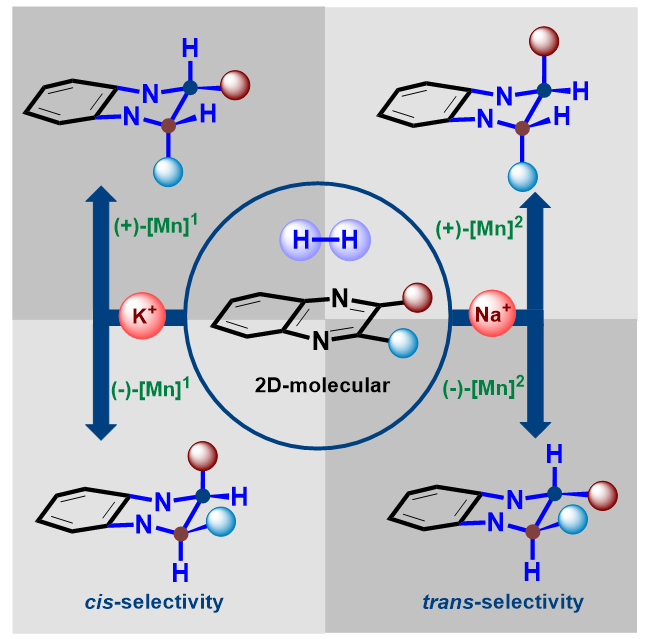
背景介绍:手性1,2,3,4-四氢喹喔啉(THQ)是一系列生物活性分子和药物先导化合物的核心骨架(图1)。通过喹喔啉类化合物的不对称氢化反应是合成该类化合物最为直接有效的方法,目前单取代喹喔啉化合物的不对称氢化反应已经发展得较为成熟。与之相比,二取代喹喔啉化合物的不对称氢化反应则研究报道较少,此类反应通常生成顺式选择性的产物。
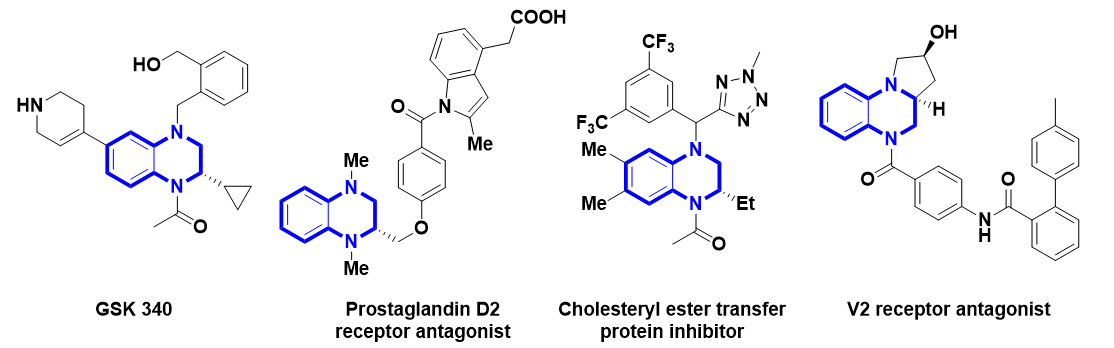
图1.含有手性四氢喹喔啉结构的代表性生物活性分子
在邻位二取代芳香杂环化合物的不对称氢化反应中,实现反式选择性是非常困难的。这是因为第一步氢化反应所形成的手性中心会显著地影响邻位不饱和键发生第二次氢化的面选择性,从而优先生成顺式产物(图2)。若要逆转第二步氢化的面选择性要求催化剂具有极强的立体选择性控制能力,才可能克服邻位手性中心的诱导效应。
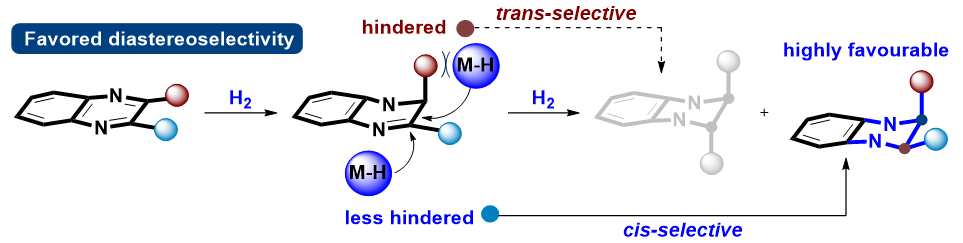
图2.二取代喹喔啉不对称氢化反应的非对映选择性控制
本文亮点:刘强课题组致力于丰产金属催化不对称氢化反应的研究,通过发展新型催化体系实现了多类手性含氮杂环化合物的高效不对称合成(Angew. Chem. In.t Ed., 2022, 61, e202202814; Angew. Chem. In.t Ed., 2021, 60, 5108.)。在前期工作中,基于双金属协同活化负氢转移的新机制,他们开发了一类结构明确的胺基阴离子双金属氢配合物催化剂,高效实现了惰性底物N-烷基亚胺类化合物的氢化反应(Nat. Chem., 2022, 14, 1233.)。在此基础上,本研究工作发展了具有高反应活性和强立体选择性诱导能力的手性双金属氢催化体系,首次实现了二取代喹喔啉类化合物的立体发散式不对称氢化反应,从单一底物出发以良好的立体选择性分别构建了具有连续手性中心四氢喹喔啉类化合物的全部四种立体异构体。
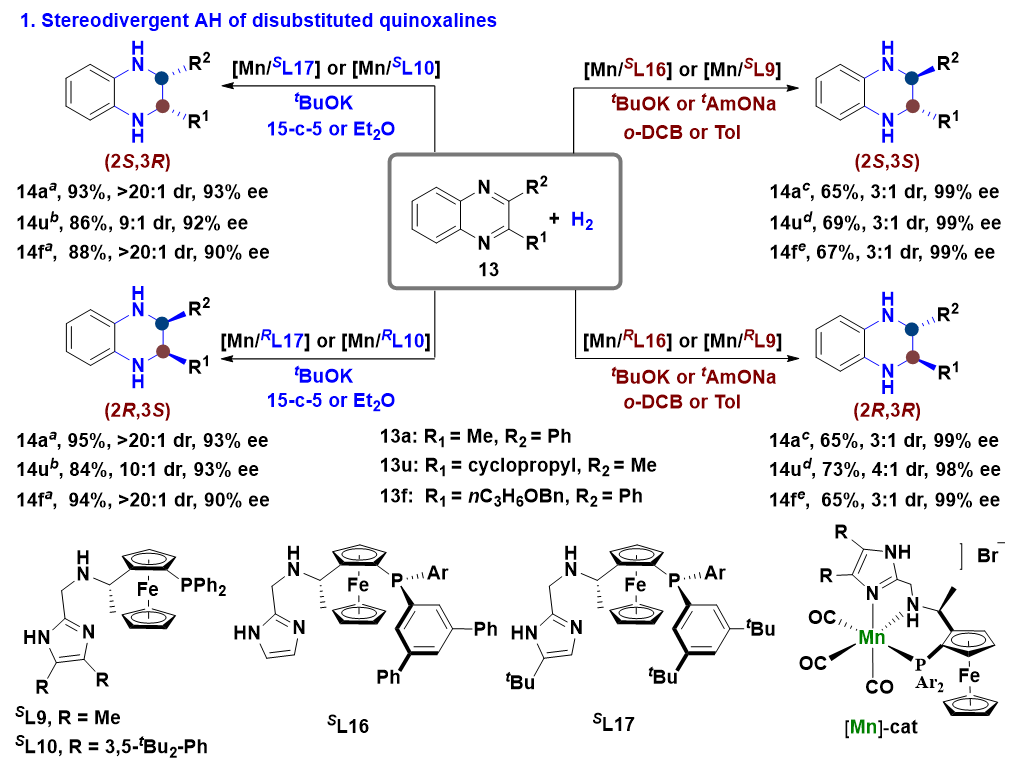
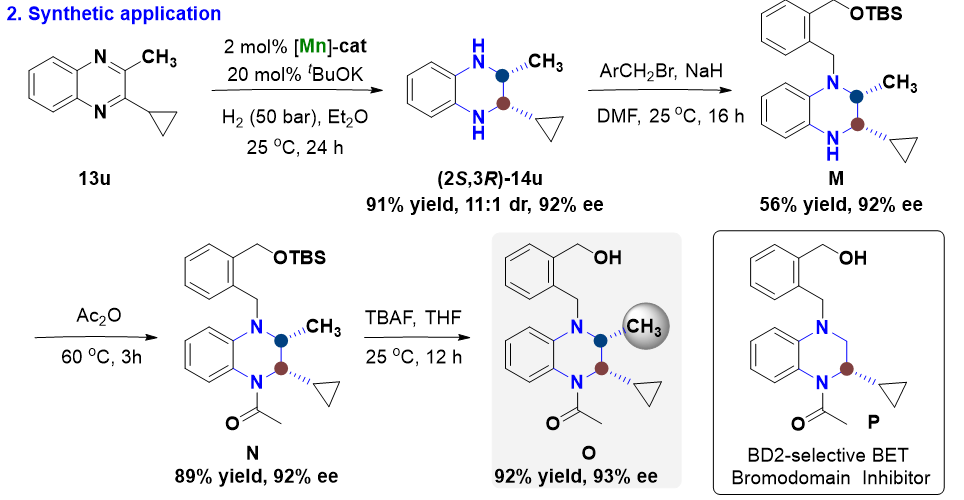
图3.喹喔啉类化合物的立体发散性不对称氢化反应及其合成应用
生物活性小分子的甲基化反应是一种精细的分子结构修饰方法,可以显著改变分子的药理活性,已经成为药物开发的一种有效工具。鉴于此,作者以双取代喹喔啉的反式不对称氢化反应为核心步骤,实现了药物先导化合物BET家族蛋白第二溴区结合域抑制剂的立体选择性甲基化反应。以上结果表明该方法可以被应用于功能分子的选择性后修饰,拓展生物活性小分子的立体化学空间(图3)。
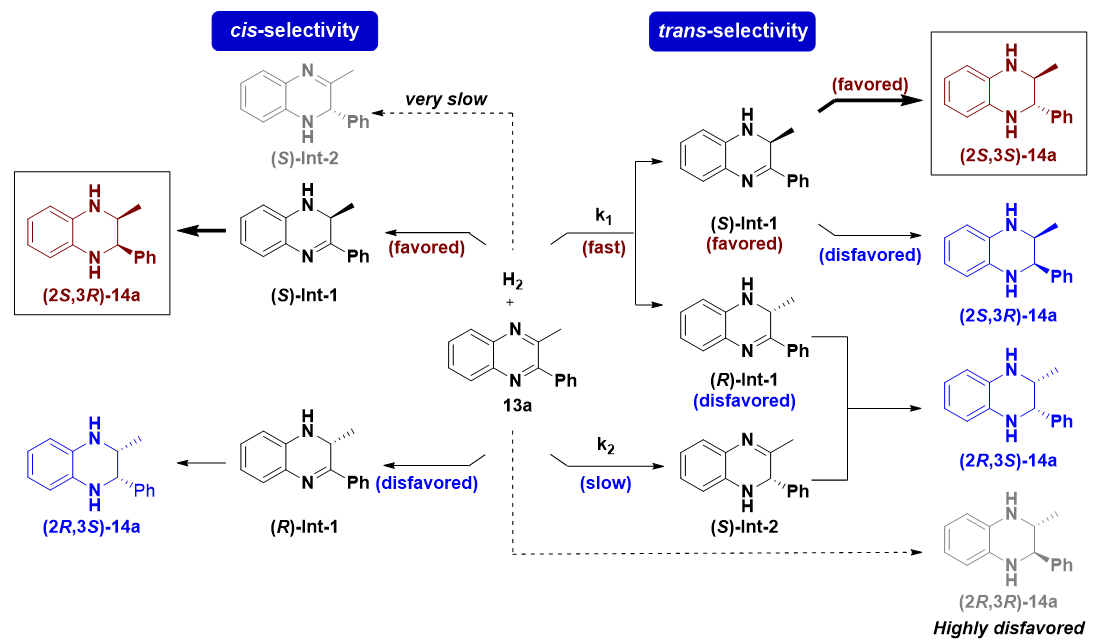
图4.反应路径分析
作者对反应机理也进行了深入的研究,基于对关键中间体的分离表征以及一系列控制实验的结果,阐明了生成不同立体异构体的反应路径(图4)。总体而言,生成顺式和反式两种构型的产物均历经了两步氢化过程。在顺式氢化反应中,首先发生烷基取代C-N双键的不对称氢化,生成具有高对映体纯度的中间体Int-1。随后,Int-1发生立体专一性的第二步氢化反应,从而高选择性地生成顺式产物。在该条件下,芳基取代C-N双键的反应活性显著低于烷基取代C-N双键,难以首先被氢化生成中间体Int-2,因此该反应表现出优异的非对映选择性。反式氢化反应同样历经了中间体Int-1的生成与转化,利用双金属氢催化体系的强立体选择性诱导能力,Int-1更倾向于生成反式氢化产物,但同时也会通过Int-1的立体专一性氢化获得少量顺式异构体。此外,在反式氢化的反应条件下,尽管芳基取代C-N双键的反应活性仍低于烷基取代C-N双键,但由于二者反应活性的差别减小,导致第一步氢化反应中也会生成少量芳基取代C-N双键被氢化的中间体Int-2。控制实验表明该类中间体仅能发生立体专一性的氢化过程生成顺式异构体,从而致使反式氢化反应的非对映选择性有所下降。
总结展望:综上所述,刘强课题组利用所发展的双金属协同催化体系,成功实现了二取代喹喔啉分子的立体发散式不对称氢化反应。该方法为获得含有两个连续手性中心四氢喹喔啉类化合物的全部立体异构体提供了一条简捷高效的合成途径。通过反应机理研究,提出了合理的反应途径并对立体选择性调控机制进行了阐释。本项工作拓展了立体发散式不对称催化反应的类型,并为含有多个手性中心杂环化合物的不对称合成提供了新思路。
文章详情:
Stereodivergent asymmetric hydrogenation of quinoxalines.
Chenguang Liu, Xufang Liu, Qiang Liu*, Chem. 10.1016/j.chempr.2023.05.006.
文章链接:https://doi.org/10.1016/j.chempr.2023.05.006.