酰胺导向铑催化的非活化内烯烃的对映选择性硅氢化反应
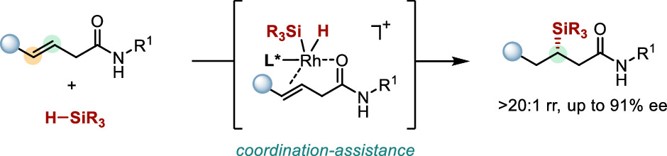
近日,清华大学李必杰课题组报告了铑催化的含酰胺基团非活化内烯烃对映选择性硅氢化反应。其中,酰胺基团的配位辅助使得硅氢化反应具有较高的区域选择性和对映选择性。
背景介绍:由于手性有机硅化合物在各领域广泛应用,使得它的合成及其转化的研究备受关注。手性有机硅化合物通常分为两类,即手性硅中心化合物以及硅基取代的手性碳中心化合物。通常利用对二氢硅烷的去对称化反应构建含硅中心的手性有机硅化合物以及对Si-H键不对称插入反应构建含碳中心的手性有机硅化合物。相对于其他构建手性有机硅化合物的方法,过渡金属催化烯烃的不对称硅氢化反应是构建碳中心手性有机硅化合物的最有效且具有原子经济性的方法之一。在此基础上,本课题组实现了三取代活化烯酰胺的不对称硅氢化反应。此外,陆展课题组报道了一种钴与手性亚胺吡啶噁唑啉配体参与催化的对映选择性硅氢化反应,用于高效合成有价值的手性二氢硅烷化合物。
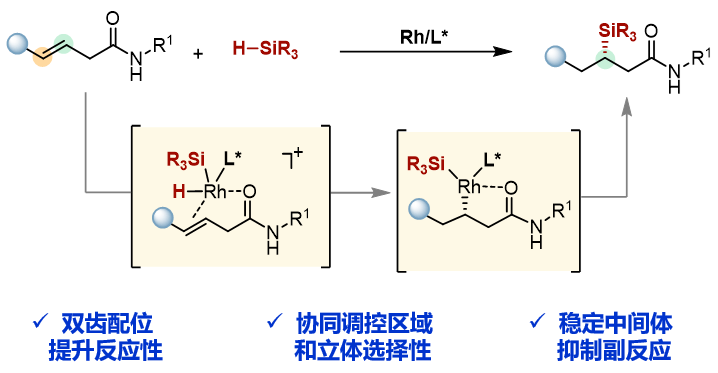
图 1 酰胺导向铑催化的非活化内烯烃的对映选择性硅氢化反应
本文亮点:
通过课题组以往的经验(Angew. Chem. Int. Ed., 2022, e202214534.),本工作设想利用配位辅助策略来实现非活化内烯烃的硅氢化反应。该方法通过金属、配体、配位基团的共同作用影响过渡金属催化烯烃的硅氢化反应的区域选择性和立体选择性。在此体系中,首先,配位基团可以与金属中心形成双配位点,进而使反应速率加快;其次,可以通过配位形成更加稳定的环状中间体,不仅有效减少烯烃异构化和β-H消除等副反应的发生,还可以影响金属铑的反应性能,使该催化反应具有良好的区域选择性和对映选择性;最后,配位基团本身可以作为产物中的一个官能团,可以进行后续的转化。基于以上设计,本工作选择从β,γ-不饱和酰胺出发与氢硅烷通过金属铑催化的硅氢化反应直接制备了高对映选择性的有机硅化合物。
作者对溶剂、温度、配体等反应条件进行了系列优化,发现配体的选择对反应结果至关重要。首先,作者测试了一系列手性配体对含有酰胺基团的烯烃1a的硅氢化反应反应性的影响。当使用 BINAP, BPE-Ph, Duphos, 富电子的Josiphos作为配体,没有硅氢化产物的生成。随后,作者尝试了贫电子的配体,亚磷酰胺骨架配体提高了反应活性,亚磷酸酯配体骨架对反应产率和对映选择性有着更加显著的影响。最后对配体上苯基进行修饰,发现当苯基上的取代基为三氟甲基时,反应能够以接近当量的产率,88% 的ee值构建了含有一个手性中心的硅化合物。
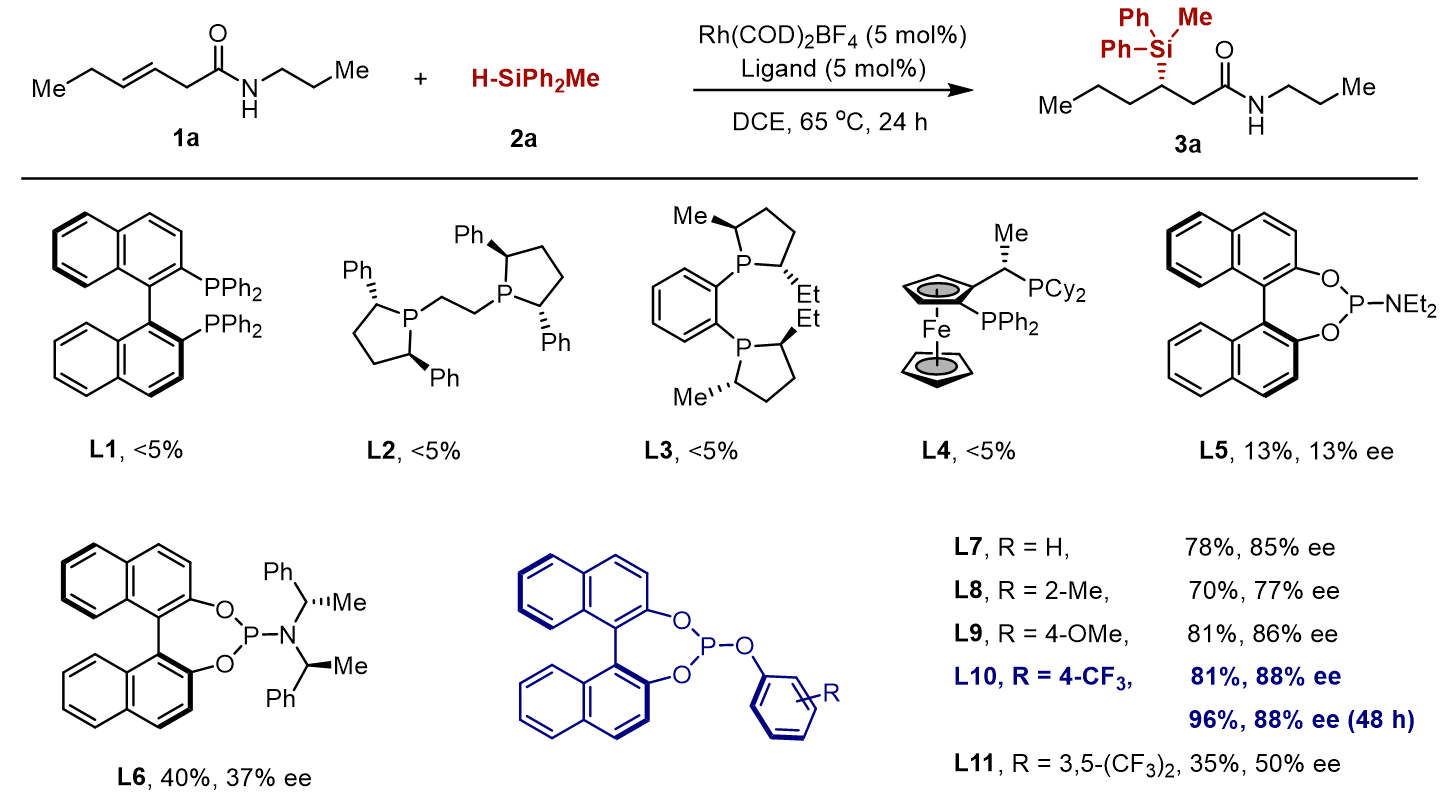
图 2 反应条件优化
得到最佳反应条件后,作者接下来评估了这种硅氢化方法的底物适用范围。
首先,测试含有不同酰胺导向基团的内烯烃。作者发现该反应适用于多种N-烷基酰胺,其中N-烷基的大小不会太影响产率或对映选择性。N-芳基酰胺有着相似的反应性。包括醚、烯烃和吲哚在内的官能团兼容性良好。
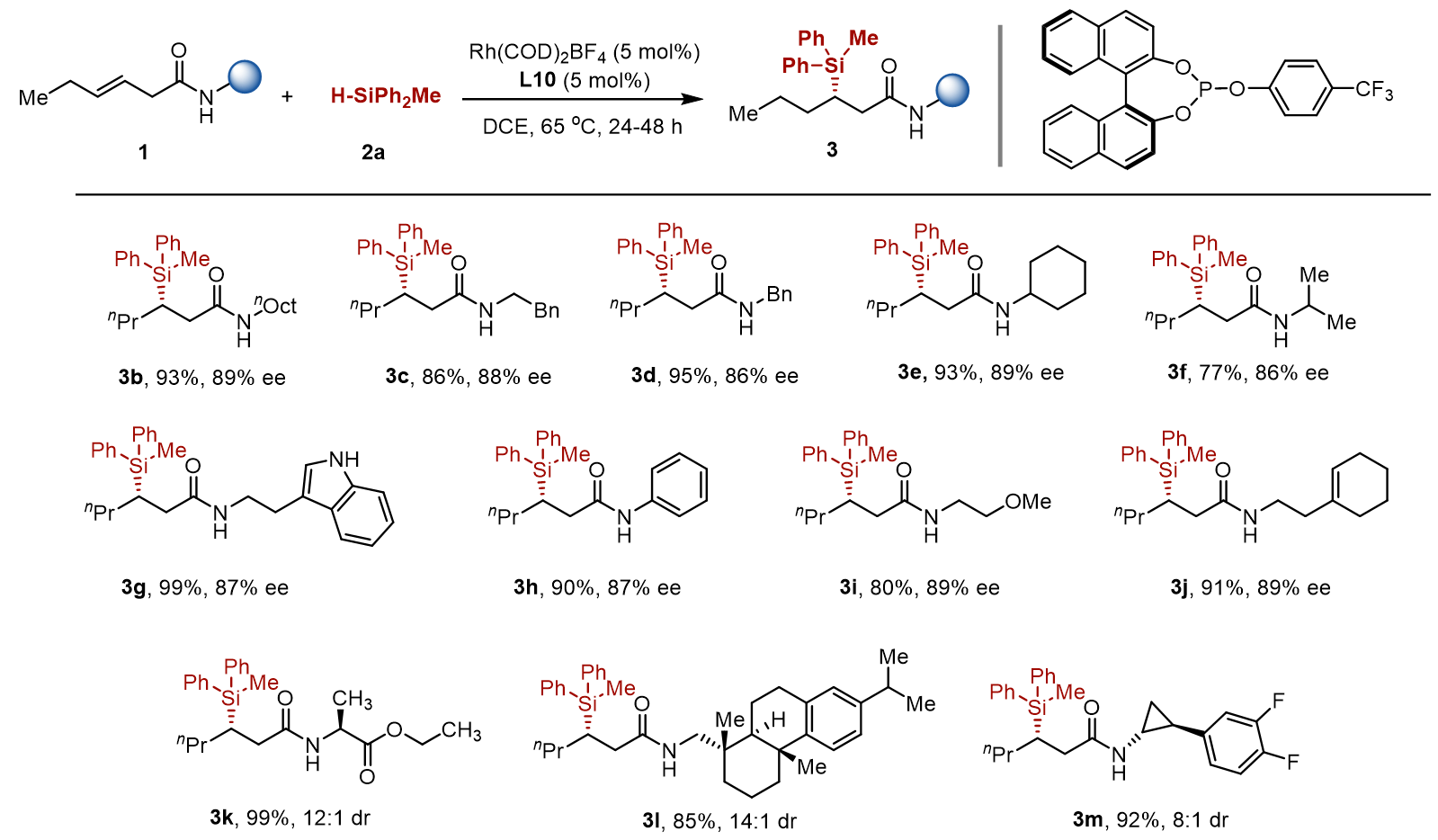
图 3 不同酰胺导向基团内烯烃底物拓展
含有氨基酸(3k)、脱氢枞胺(3l)和环丙胺(3m)衍生物的β,γ-不饱和酰胺同样可以较好的发生区域和对映选择性硅氢化,这证明了催化体系对相对复杂分子功能化的潜力。对于含有芳基取代基的烯烃底物1p,硅氢化发生在芳基的β位而不是α位置,这表明酰胺导向使反应具有良好的区域选择性。位阻较大的异丙基(3q)或富电子芳基(3r)参与反应时对映选择性略有降低。包括烷基卤化物、甲硅醚、醚、甲磺酸酯、缩醛和醋酸酯在内的官能团都与催化体系是兼容的。
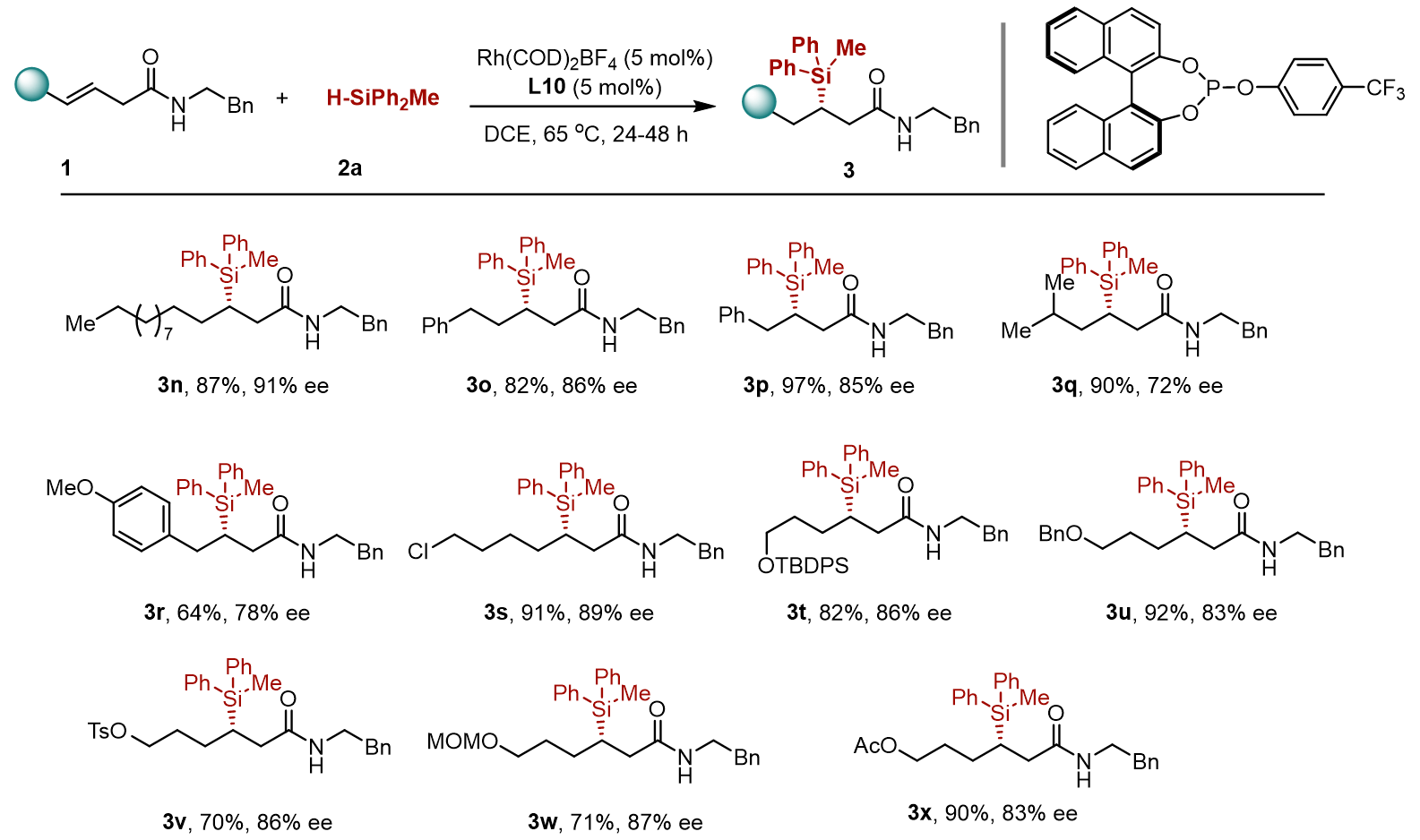
图 4 β,γ-不饱和酰胺底物拓展
最后,作者测试了各种氢硅烷对该催化体系的适用性。二苯基烷基硅烷的都可以以良好的产率和对映选择性发生硅氢化反应得到相应产物(3y-3aa)。而三烷基硅烷(3ab, 3ac)和苯基二甲基硅烷(3ad)的对映体选择性虽略有降低,但对产率影响不大。 Ph3SiH和Ph2SiH2 在该体系中不参与反应。
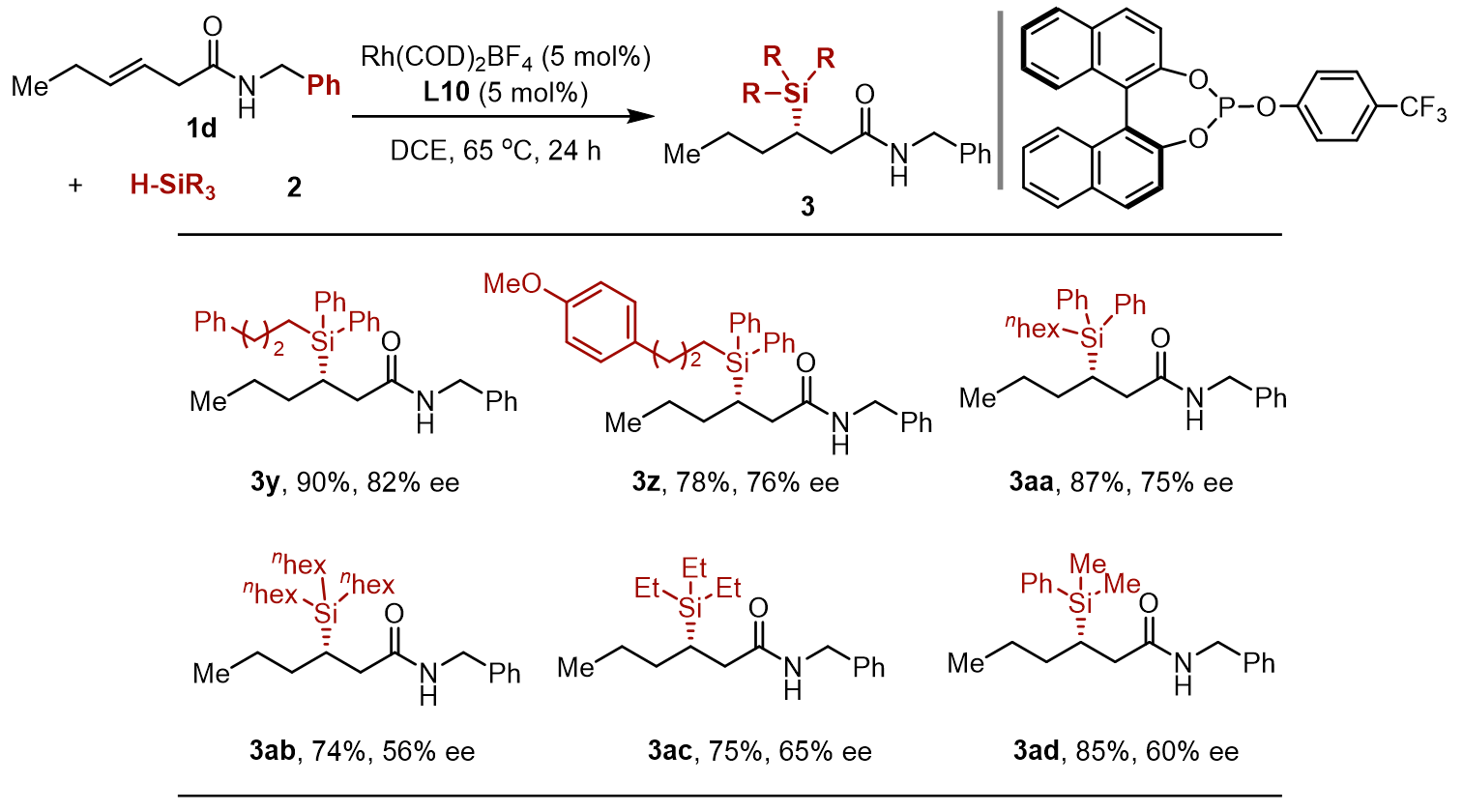
图 5 硅烷底物拓展
为体现该催化不对称硅氢化反应的实用价值,本工作进行了克量级的实验。当反应的规模为 4.6 mmol 时,在标准条件下,仍然可以不影响收率和对映选择性得到目标产物。作者进一步探究了产物的官能团转化。例如,酰胺底物可以很容易地被还原,生成手性胺4。此外,C-Si键可以通过Tamao氧化得到手性仲醇5。在上述的转化过程中,产物的区域选择性和对映选择性均得到了很好的保持。
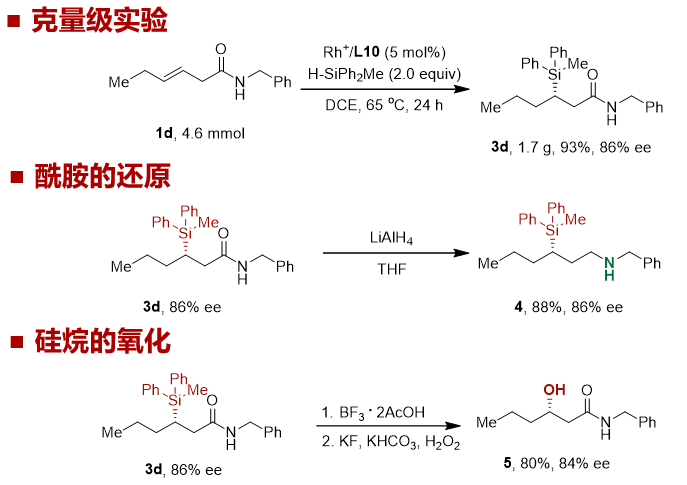
图 6 反应合成应用
最后,作者对反应机理进行了初步研究。1a的酯类似物参与的硅氢化反应没有得到产物,表明酰胺基团作为该反应的配位基团的重要性。为了观察β,γ-不饱和酰胺在硅氢化之前是否经历了α,β-不饱和酰胺的异构化,所以尝试用α,β-不饱和酰胺直接硅发生氢化反应。然而,仅观察到氢化还原产物。从而排除烯烃迁移后发生硅氢化的路径。作者利用氘代氢硅烷进行同位素标记实验,深入了解反应机理,并基于以往的工作,提出了以下催化循环路径。首先,铑催化剂与氢硅烷反应生成硅基铑氢络合物6,它可以以二聚体或聚合物形式存在。随后,β,γ-不饱和酰胺1a配位到金属中心,迁移插入Rh-H键生成中间体8。最后,C-Si还原消除产生硅氢化产物。由于烯烃迁移插入到Rh-H键中是可逆的,因此还原消除形成C-Si键很可能是决速步。
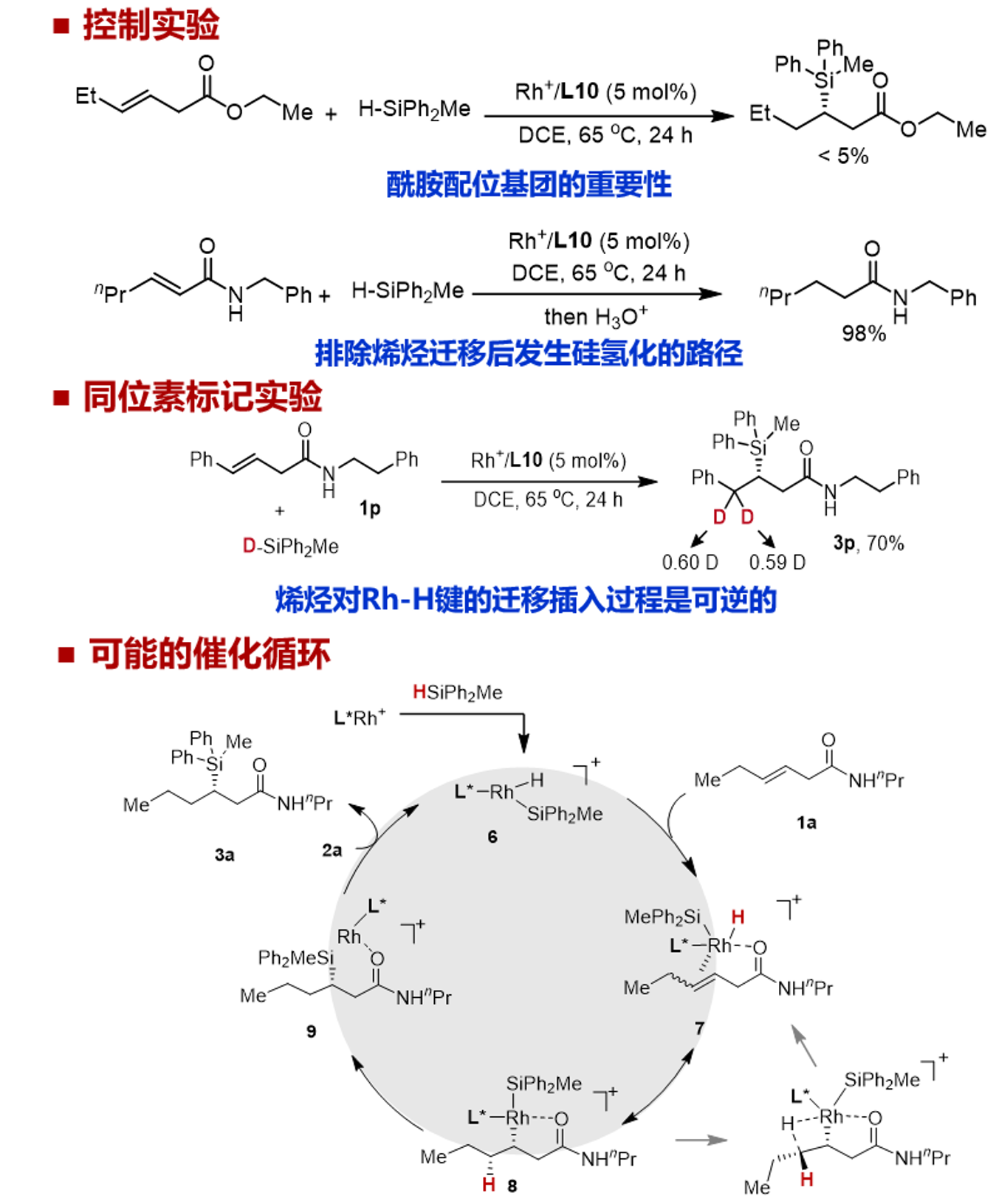
总结展望:
本工作以阳离子铑作为催化剂、亚磷酸酯为配体,实现了β, γ-不饱和酰胺的β位的不对称硅基化反应,能够以较好的区域选择性和对映选择性高效构建手性有机硅化合物。从简单易得的原料出发,以100%的原子经济性构建目标化合物。该硅氢化反应有着较好的底物普适性和官能团兼容性。接下来将进一步发展催化体系,提高催化剂的反应活性,希望能够通过配位辅助策略使三取代非活化内烯烃发生不对称硅氢化反应。从而构建季碳手性中心以及连续两个手性中心的有机硅化合物。
文章详情:
Amide-Directed, Rhodium-Catalyzed Enantioselective Hydrosilylation of Unactivated Internal Alkenes.
Zhang, W.-R.; Zhang, W.-W.; Li, H.-R.*; Li, B.-J.*, Org. Lett. 2023, 25, 1667-1672.