锰催化喹啉衍生物的不对称氢化反应
手性饱和含氮杂环化合物结构广泛存在于天然产物、生物活性分子和药物分子中。含氮芳杂环化合物的不对称氢化反应是构筑该类化合物最为直接有效的方法之一。然而,能够实现这种不对称转化的催化体系目前仅限于贵金属催化剂(钌、铑、铱等)和FLP催化。由于可持续化学发展的需求,利用储量丰富、生物兼容性好的廉价金属代替贵金属发展新型的催化剂备受关注。近年来,一系列新型高效的手性廉价金属催化剂(铁、钴和镍等)相继被发展出来,并成功地应用于不对称氢化反应中。然而,关于手性锰氢化催化剂的相关研究还非常有限,目前仅局限于在酮类化合物的不对称氢化反应中的应用。在前期研究的基础上,近日清华大学刘强副教授和郑州大学蓝宇教授团队合作发展了一种新型手性锰催化剂,实现了首例廉价金属催化的芳杂环化合物不对称氢化反应。该催化体系适用于2-取代喹啉和双(2-喹啉基)-甲烷的不对称氢化,展现出良好的对映选择性和非对映选择性。
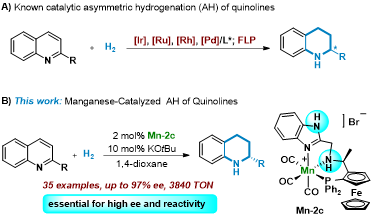
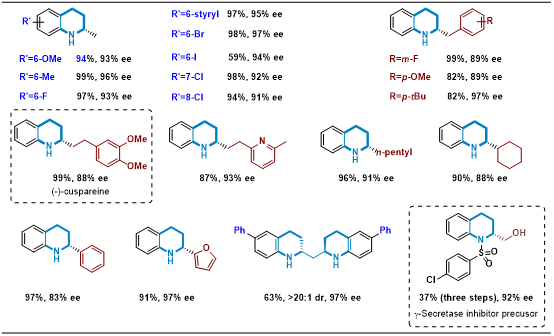
作者设计并合成了一系列二茂铁基NNP型手性配体并通过原位生成催化体系对配体的催化性能进行了评估。结果表明:基于NH咪唑结构的配体在模型反应中展现出优异的催化活性和对映选择性(97%产率,97% ee)。在最优反应条件下,作者对一系列2位烷基、芳基取代喹啉底物的范围进行了考察。结果表明:该反应对卤素、碳碳双键和三键等可被还原性基团能很好地兼容,含有其它取代基(如苄基、长链烷基、环烷基以及杂环等)的底物也都可以顺利地参与反应,以良好的产率和优异的ee值得到相应的手性四氢喹啉产物。
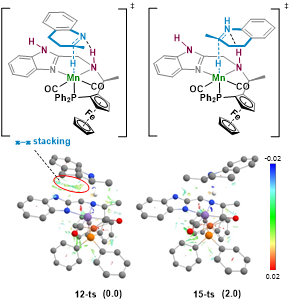
作者进一步通过理论计算揭示了反应的手性诱导机制。在对映选择性决定步骤C=N双键的氢化过程中,由于配体与芳杂环底物之间的π-π相互作用,使得形成S构型产物的过渡态与R构型产物相比稳定2.0 kcal/mol,从而使得形成S构型产物更为有利,计算结果与实验观测对映选择性相符。配体中咪唑环的NH结构具有较小的体积,保证了有效的π–π相互作用,在对映选择性诱导中起到了关键作用。
综上,刘强副教授和蓝宇教授团队合作发展了一种的新型钳形手性锰催化剂,并在一系列喹啉类衍生物的不对称氢化反应中展现出优异的反应活性和对映选择性。反应的催化剂转化数高达3860,催化活性可与目前报道的高效贵金属催化剂相媲美。这是首例廉价金属催化的芳杂环化合物不对称氢化反应的报道,加深了对锰元素金属有机化学和催化功能的认识,对新型手性锰催化剂的设计和应用具有借鉴和指导意义。