吲哚生物碱Arborisidine的催化不对称全合成
Arborisidine是一种于2016年分离得到的新型吲哚生物碱,具有抑制胃癌细胞的潜在能力,其天然来源极为稀少。该分子崭新的五环笼状结构和潜在的生理活性吸引了合成化学家们的关注。近两年,Snyder课题组(J. Am. Chem. Soc. 2019, 141, 7715)和祝介平课题组(J. Am. Chem. Soc. 2020, 142, 14276)先后以手性诱导和手性催化的Pictet-Spengler反应作为关键不对称合成步骤实现了该分子的全合成。尽管如此,由于构建含有两个四级碳立体中心的环己酮骨架以及桥联氮杂五元环所带来的挑战,探索能够有效合成arborisidine分子的全新合成策略仍是一项具有吸引力的研究课题。
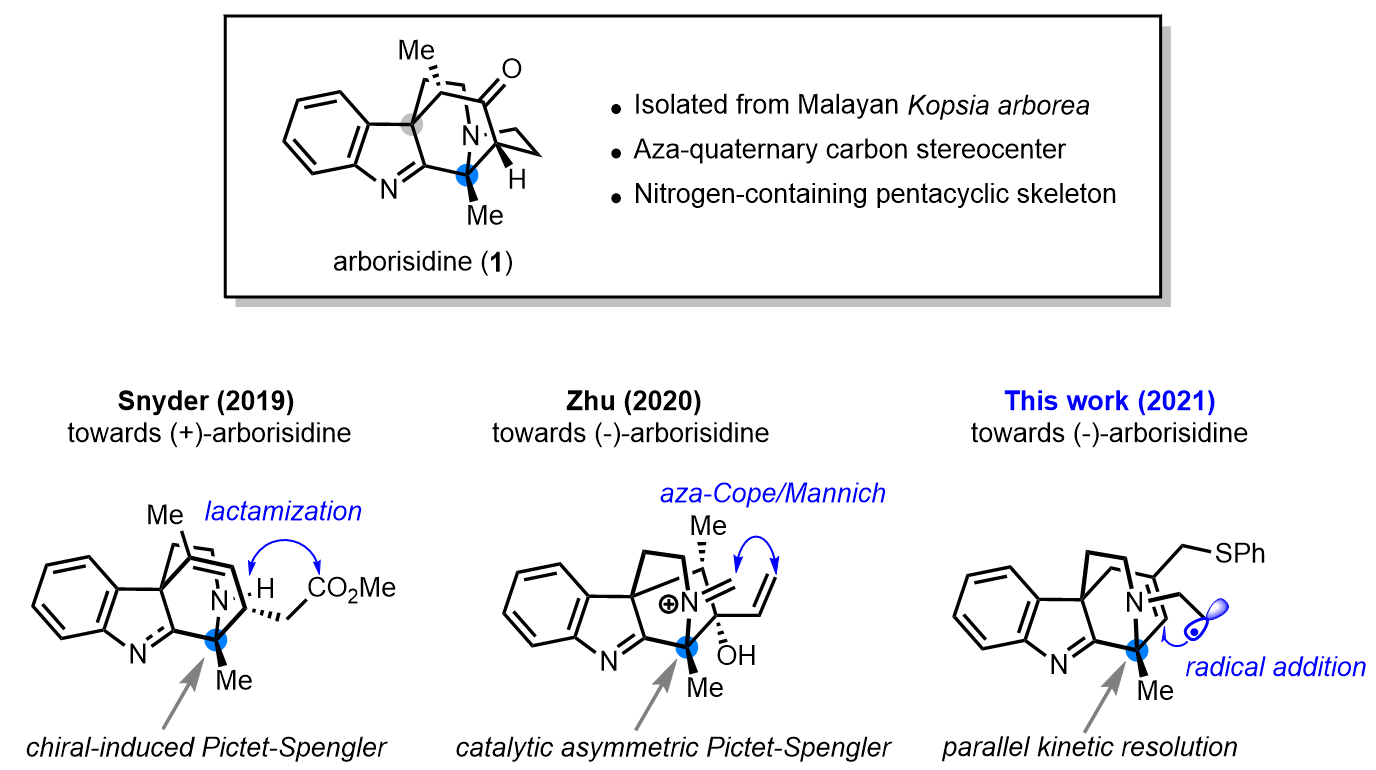
最近,清华大学化学系基础分子科学中心焦雷副教授课题组发展了一条新颖的催化不对称合成路线,以基于不对称烯丙基烷基化反应的平行动力学拆分和自由基环化反应为关键步骤,成功实现了(–)-arborisidine的全合成。
在探索该分子内氮杂四级碳立体中心构建方法的过程中,作者偶然发现了钯催化烯丙基烷基化反应(AAA)体系中的平行动力学拆分(PKR)现象。在最优条件下,分子内同时带有吲哚和烯丙基醋酸酯结构的消旋底物(±)-8中的(R)-对映体选择性地发生C3-烯丙基化反应生成(+)-7,而(S)-对映体选择性地发生N-烯丙基化反应生成(+)-11。作者通过反应进度监测发现该反应中这两个过程以近乎相等的速率发生,两种产物的ee值和产率符合平行动力学拆分的基本规律eex•[x] = eey•[y],并通过DFT计算详细研究了两条平行途径中的选择性控制因素。

在获得光学活性的关环产物(+)-7后,作者通过简单的化学转化获得了关环前体(–)-6,并在经典的自由基引发反应条件下实现了跨环自由基C-C键形成反应,完成了arborisidine分子完整骨架的构建。通过后续的官能团转化,作者顺利实现了该天然产物分子的全合成。值得一提的是,人们在之前的合成研究中使用羰基α碳负离子的分子内亲核取代反应来形成C14-C15键的尝试均以失败告终,而自由基机理的C-C键形成反应则很好地解决了这一难题。
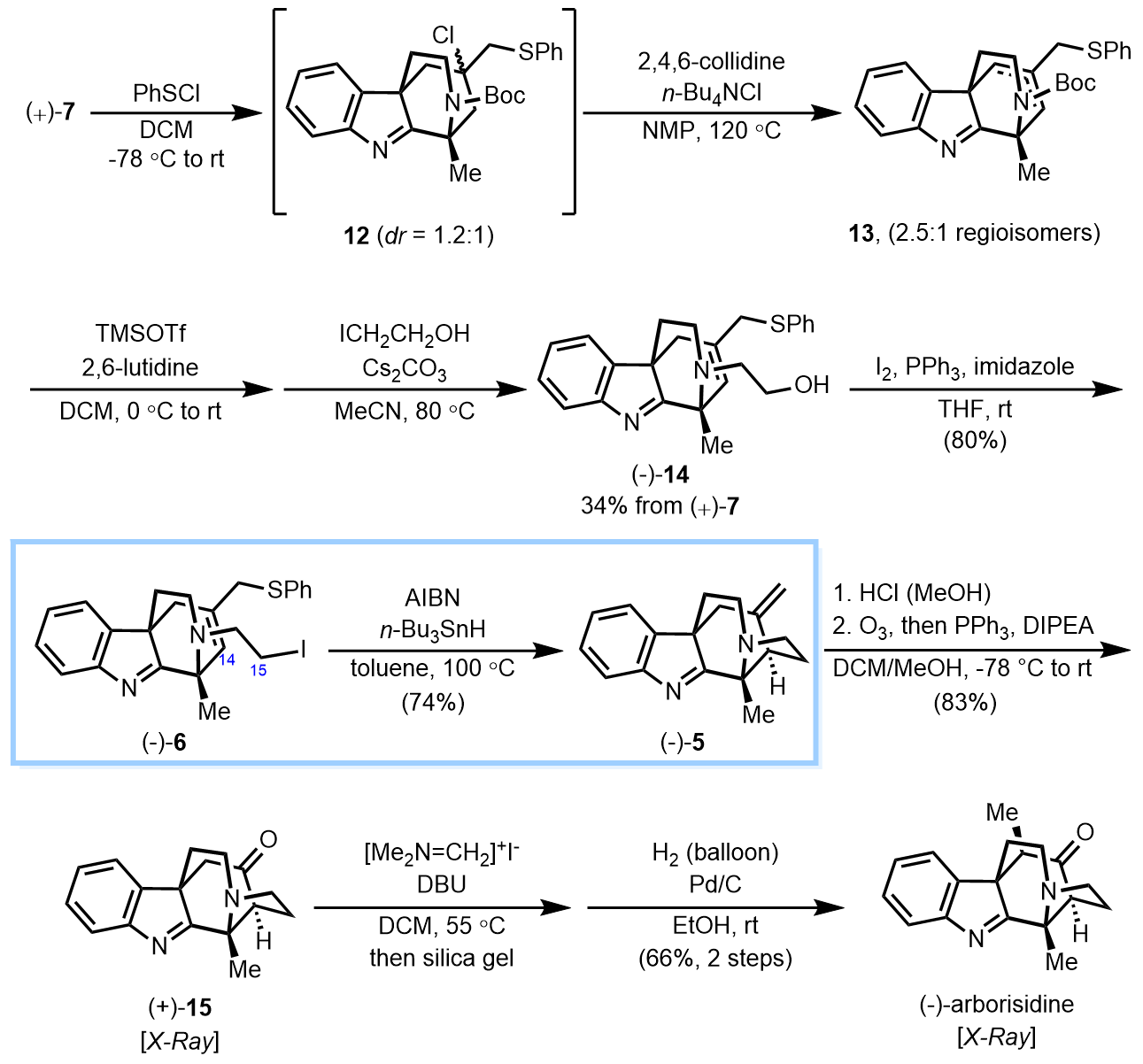
在该工作中,焦雷课题组实现了生物碱分子arborisidine的不对称全合成,并在研究过程中发现了基于分子内AAA反应的平行动力学拆分,这是首例在不对称烯丙基烷基化反应体系中实现平行动力学拆分的报道。这项工作发展了arborisidine分子的全新不对称合成策略,并启发人们深入挖掘AAA反应体系中更多新颖反应模式的可能性。