锰催化3H-吲哚衍生物不对称氢化反应
近日,清华大学刘强课题组在Angew. Chem. Int. Ed.上发表了研究成果,通过钳形锰催化3H-吲哚衍生物的不对称氢化,实现了手性吲哚啉化合物的高效、高选择性合成。
手性吲哚啉化合物结构广泛存在于天然产物、生物活性分子和药物分子中。由于反应物广泛易得并且产物易于分离,吲哚化合物的不对称氢化反应是构筑该类化合物最为直接有效的方法之一。与1H-吲哚相比,3H-吲哚化合物的不对称氢化反应可以得到3位带有季碳中心的产物,在合成方面体现出更大的价值。然而,由于底物位阻较大以及相对富电子的特性,该类化合物的不对称氢化长久以来是一个具有挑战性的问题,目前仅有两例报道展现出良好的对映选择性和一定的普适性(超过90%ee,3个以上实例)。此外,已知反应体系主要依赖于贵金属且存在着条件苛刻,官能团兼容性受限等问题,在一定程度上制约了该反应在有机合成中的广泛应用。
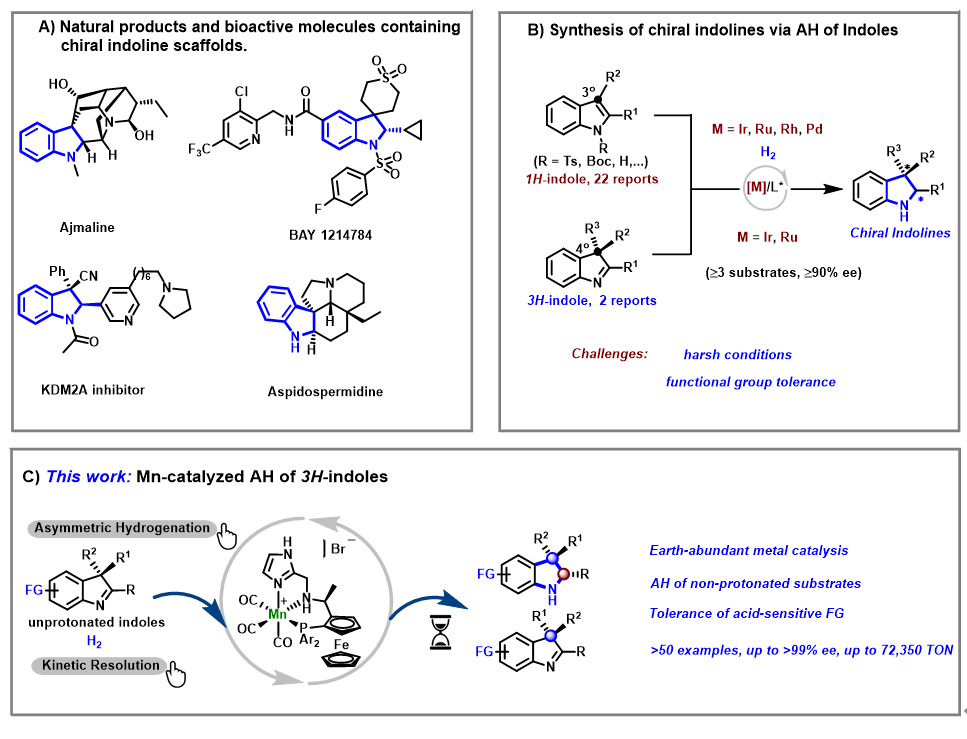
图1 研究背景以及课题设计
由于可持续化学发展的需求,一系列高效的新型手性丰产金属催化剂(铁、钴和镍等)相继被发展出来,并成功地应用于不对称氢化反应中。然而,在该类反应中手性锰催化剂的相关研究还处于初级阶段,目前基本上仅局限于羰基类化合物的不对称氢化反应。2021年,清华大学刘强课题组发展了一类新型手性锰催化剂并实现了喹啉类化合物的不对称氢化反应(Angew. Chem. Int. Ed. 2021, 60, 5108.)。在前期研究的基础上,他们通过对手性锰催化剂的进一步结构优化,高效地实现了多取代3H-吲哚的不对称氢化反应,催化剂转化数高达7万以上,是目前为止丰产金属催化不对称氢化反应的最高记录(Angew. Chem. Int. Ed. 2022, e202202814.)。该催化体系可以直接氢化未经活化的3H-吲哚底物,从而良好地兼容吡啶等强碱性及强配位性官能团。已知的贵金属钌催化体系则需要通过质子化过程对3H-吲哚进行活化才能发生氢化反应,因此尚不能兼容上述对质子酸敏感的官能团。
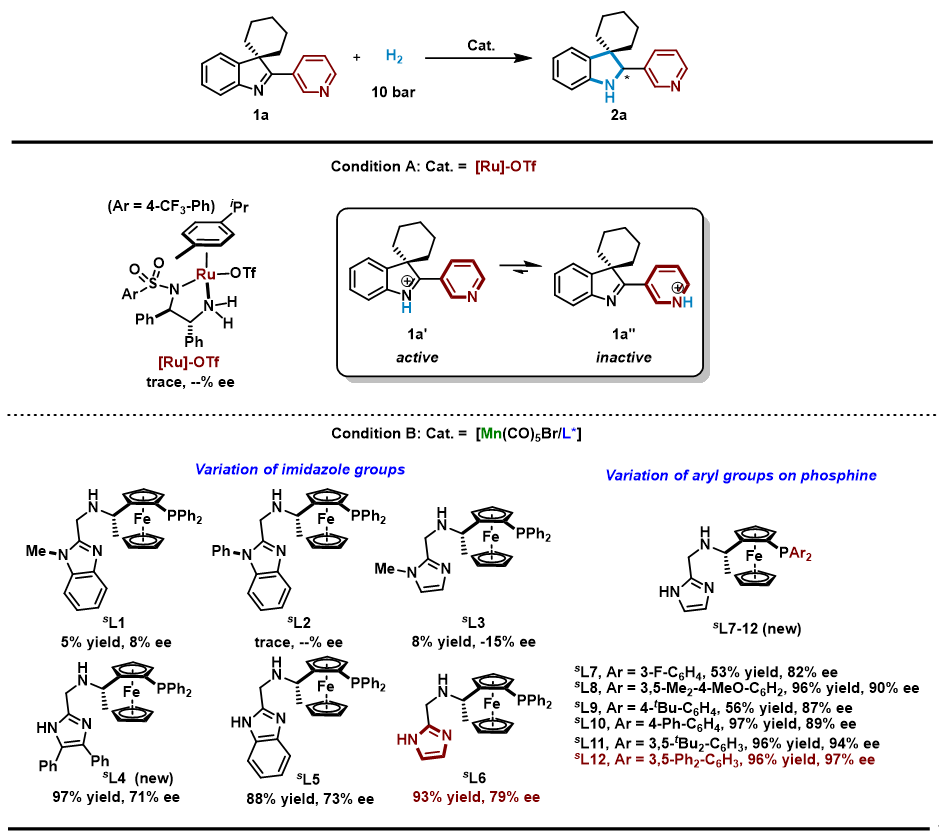
图2 模型底物优化
作者首先选取含有吡啶基的3H-吲哚作为模型底物,与文献报道在该类反应中表现最为优异的钌催化体系进行对比,结果表明:在钌催化体系中,碱性基团的存在阻碍了高活性质子化亚胺中间体的形成,从而使得该类底物完全没有反应活性。与之相比,在锰催化体系中氢化过程不依赖于对底物的质子化,从而有效地改善了反应体系的官能团兼容性,通过对配体结构进行精细修饰,最终在模型反应中以优异的催化活性和对映选择性(96%产率,97% ee)得到目标产物。
在最优条件下,对一系列2位烷基、芳基取代3H-吲哚底物的适用性进行了考察,结果表明:酯基、碳碳双键和三键等可被还原的基团均可以被很好地兼容,含其它取代基(如苄基、长链烷基、环烷基以及杂环等)的底物也都可以顺利地进行反应,以良好的产率和优异的ee值获得相应的手性吲哚啉衍生物。
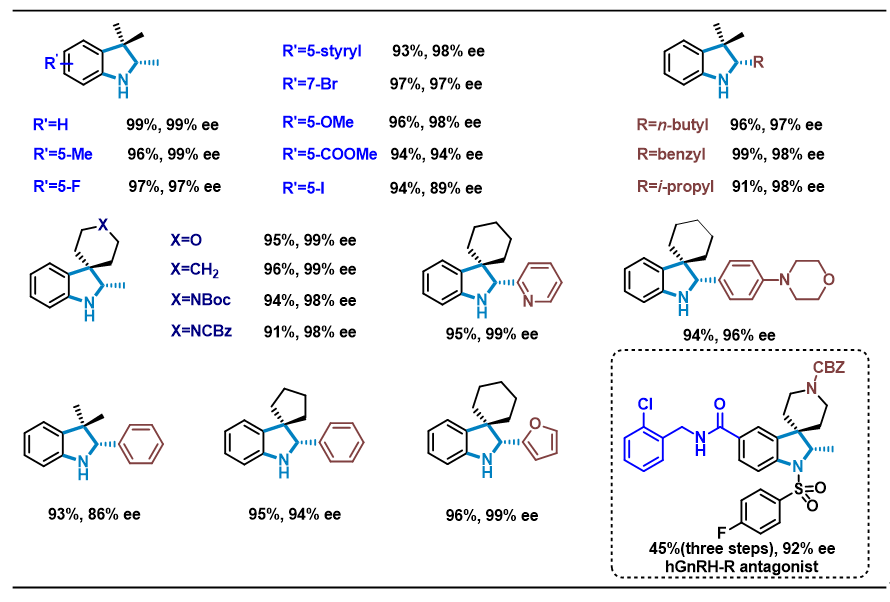
图3 底物适用性考察
对于3位含季碳中心的外消旋吲哚底物,该催化体系可以对不同异构体进行有效的手性识别,高效地实现动力学拆分过程,以高对映选择性同时获得含季碳手性中心的吲哚啉产物和吲哚底物,为该类重要的手性骨架提供了一种简洁、高效的合成方法。
最后,作者对反应进行了放大,在较低的催化剂载量(13ppm)下,底物可以以较高的产率和对映选择性得到相应的产物,反应过程中的氢气压力变化可通过压力传感器进行监测,整个反应过程的转化数高达72,350,进一步阐明了该反应潜在的工业应用价值。
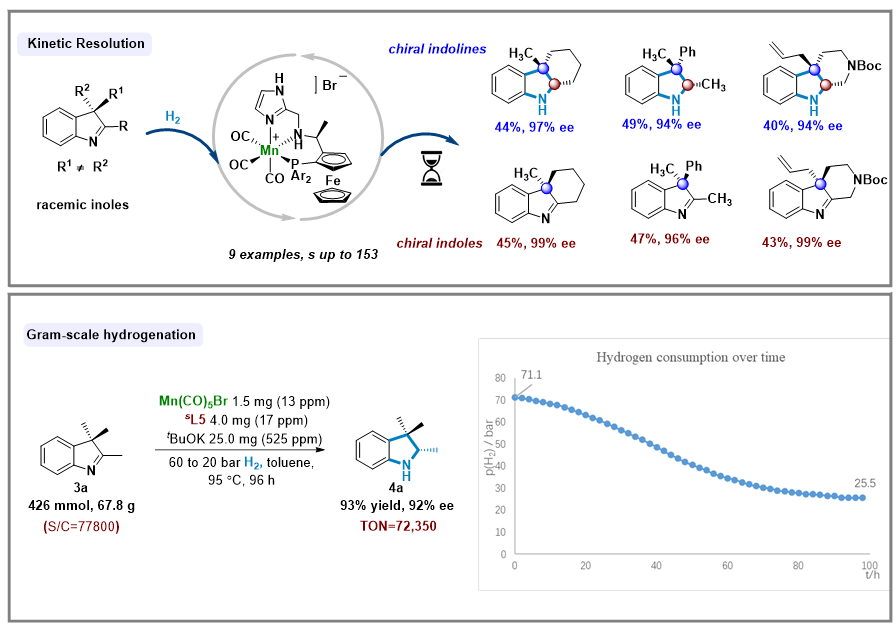
图4 外消旋吲哚底物的动力学拆分及放大实验
综上所述,刘强课题组利用所发展的新型手性锰催化剂实现了3H吲哚类衍生物的高效、高对映选择性不对称氢化反应,催化剂转化数高达72350,是迄今为止丰产金属催化不对称氢化反应的最高记录。锰催化体系的反应机制不同于已知的贵金属催化体系,从而突破了该类反应难以兼容强碱性及配位性基团的局限,彰显了丰产金属催化的独特优势和应用潜力。本项工作显著拓展了锰催化不对称氢化反应的适用范围,为进一步发展超高效手性丰产金属催化剂奠定了重要的基础。
原文链接:https://onlinelibrary.wiley.com/doi/abs/10.1002/anie.202202814