钴/路易斯酸协同催化醛酮化合物和醇的还原醚化反应
近日,清华大学刘强课题组在Chem Catalysis上发表了研究成果,开发了一种新型的钴/路易斯酸协同催化体系,使用氢气作为还原剂,实现了羰基化合物与醇高效的还原醚化反应。
醚类化合物的合成是一类重要的转化反应,在学术研究和化工生产中均获得了重要的应用。威廉姆逊醚合成法是一种历史悠久的方法,可以利用醇类化合物和卤代烃在碱性条件下通过 SN2 取代合成伯烷基醚。然而,在涉及仲或叔烷基卤化物的情况下,卤代烃的消除反应往往占据主导。使用氢气作为还原剂将羰基化合物与醇进行还原醚化反应代表了一种理想的替代方法,具有反应物广泛易得、原子经济性高和产物多样性等优点。然而,由于醇具有较弱的亲核性,与还原胺化反应中的亚胺中间体相比,氧鎓离子中间体的形成更困难,易发生更多副反应途径,例如羰基化合物的还原脱氧、脱水和自身醚化等(图1B)。因此,与发展较成熟的还原胺化相比,相应还原醚化反应的发展远远落后(图1A)。已知的均相催化体系通常仅适用于有限的底物类型,并且需要使用大过量的醇才能获得高选择性,而多相催化体系的官能团兼容性较差,特别是在底物中很难兼容芳烃。
作者设想过渡金属催化剂和路易斯酸催化剂的协同使用有望实现高选择性的还原醚化(图1C)。 路易斯酸催化剂将促进(半)缩醛中间体的生成,以及后续转化为氧鎓离子或烯基醚的过程,这些关键中间体可以进一步通过过渡金属催化的氢化反应进一步转化为醚类产物。尽管如此,羰基化合物的直接氢化产物仍然难以避免,预期其可与醇类底物进行路易斯酸催化的醚化反应,同样生成目标产物,最终实现殊途同归,避免上述各种副产物的生成。基于此,作者报道了一种新型的钴/路易斯酸协同催化羰基化合物和醇的高选择性还原醚化反应,成功地实现了包括药物和天然产物衍生物在内的多种醚类产品的高效合成。
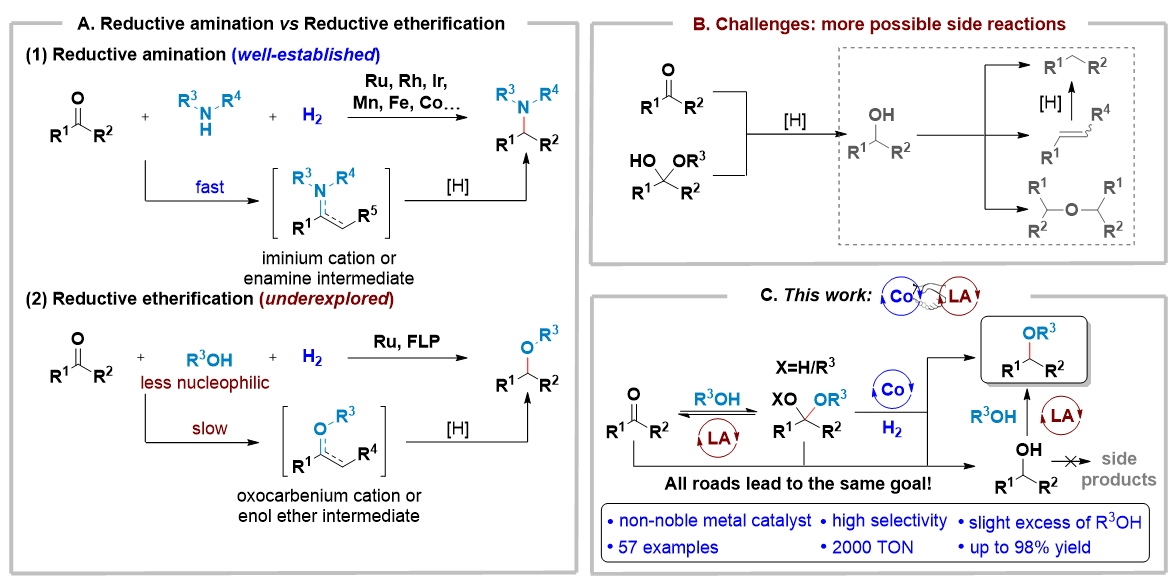
图1:研究背景及课题设计
作者选取苯乙酮为模型底物,进行了一系列的控制实验,探索反应机理(图2)。In(OTf)3 不存在时,还原醚化选择性显著降低,其中直接氢化和自身醚化副产物 4 和 5 的产率分别为 35% 和 18%(图 2A)。此外,使用 In(OTf)3 作为路易斯酸催化剂,直接氢化产物 4 以 99% 的产率顺利转化为目标的醚产物 3(图 2B)。以上结果显示了路易斯酸催化剂在选择性控制中的关键作用。此外,在没有醇类底物参与的情况下,苯乙酮的氢化也可以发生,进而形成自身醚化产物5和脱水产物6(图2C)。缩酮 7 的氢解可以得到相应的醚产物 9,这表明(半)缩酮中间体是还原醚化反应可能的中间体(图 2D)。
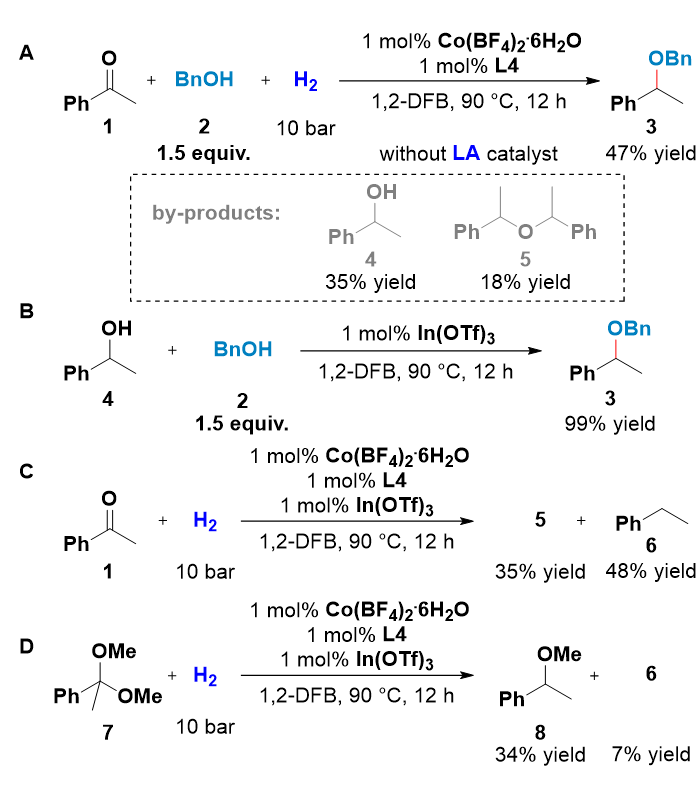
图2:控制实验
氘代实验表明,在氘气氛围下,烷氧基α 位被完全氘代,β 位被部分氘代。β 位的氘代比例可能部分由苯乙酮与由苯乙酮和氘气生成的氘代 1-苯基乙醇之间的 H/D 交换引起。尽管如此,氧鎓离子和烯醚中间体都可能在路易斯酸催化剂存在下生成,最终通过钴催化氢化成相同的醚产物。根据α 位和 β 位不同的氘化率,可推测氧鎓离子的形成与转化是该反应的主要途径(图3)。
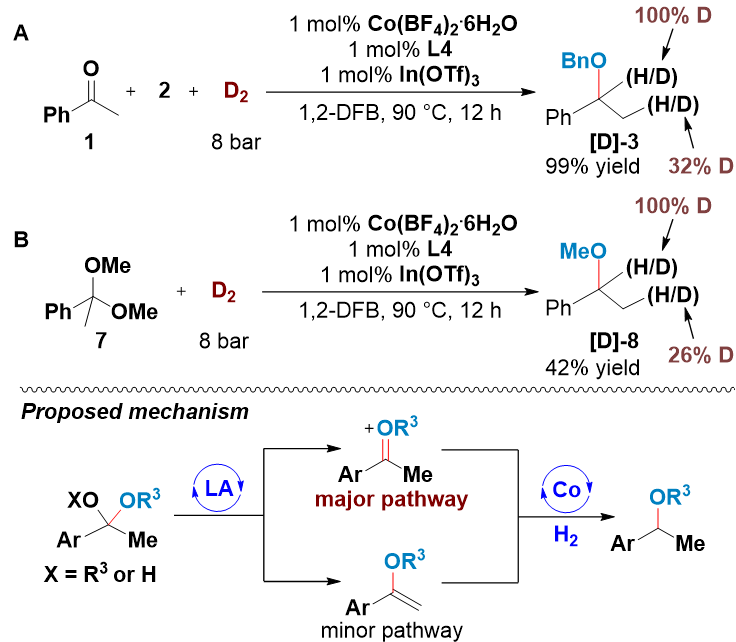
图3:氘代实验
作者随后考察了底物的适用范围(图4),该反应体系展现出广泛的底物适用性,酮、醛与一级醇、二级醇相互组合均能以高选择性生成目标的醚类产物。反应能够兼容呋喃、噻吩、卤素、三氟甲基、酯基以及缩醛等官能团。作者利用还原醚化反应对薄荷醇,龙脑,β-雌二醇等天然产物进行了衍生化,制备了多种结构复杂的醚类分子。
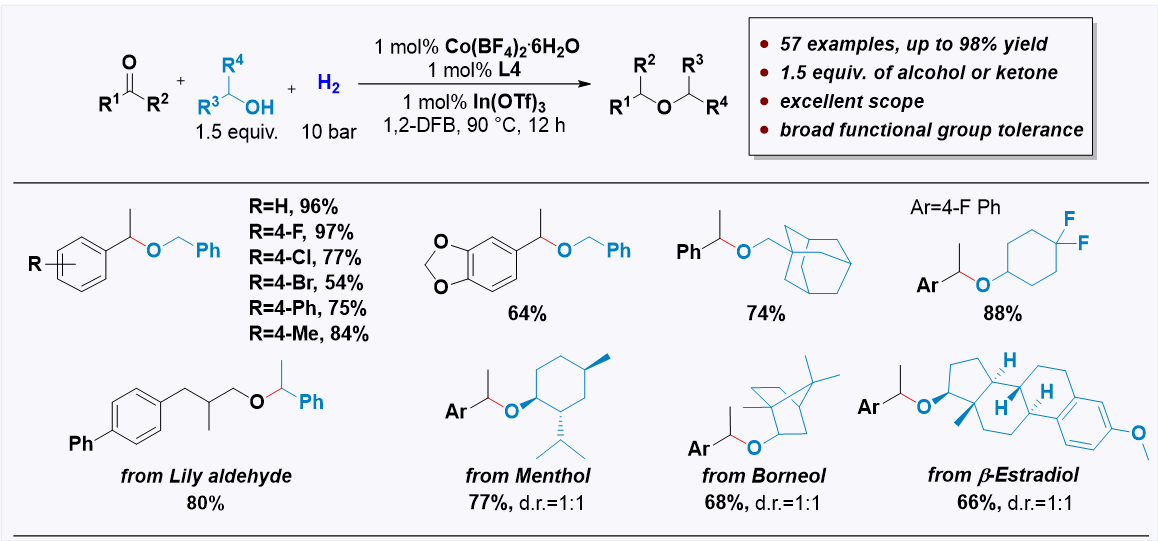
图4:部分底物范围展示
作者利用钴/路易斯酸协同催化的还原醚化反应实现了药物分子伐诺司林(Vanoxerine)的高效合成(图5)。从商业可得的原料4'4-二氟二苯甲酮出发,经过三步简单的反应转化能够以52%的收率获得目标的药物分子,而已经方法则需要使用4'4-二氟二苯甲醇和毒性较高的2-氯乙醇作为起始原料。
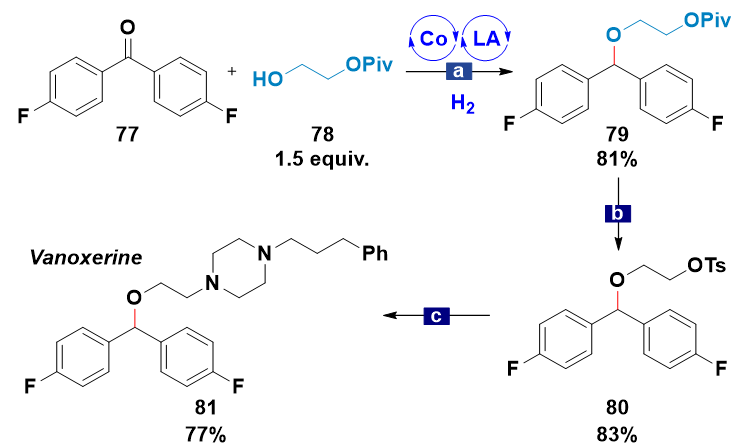
图5:合成应用
总结:
作者发展了一类新型的钴/路易斯酸协同催化体系,实现了以氢气作为还原剂的高效还原醚化反应。路易斯酸催化剂的引入对于反应选择性调控至关重要,巧妙地促使不同的反应途径生成相同的目标产物。这种还原醚化方法为一系列大位阻二烷基醚(包括药物分子以及天然产物衍生物等)的合成提供了一种简洁、高效的新方法,将进一步促进协同催化体系的发展及其在合成化学中的应用。
论文链接:https://doi.org/10.1016/j.checat.2022.03.001