酰胺导向非活化内烯烃的不对称硼氢化反应
近日,清华大学李必杰课题组报导了铑催化烯丙基酰胺类底物的不对称硼氢化反应。反应催化体系简单,选择性好,相关结果发表在J. Am. Chem. Soc上。
胺类化合物广泛存在于自然界中,具有γ-手性中心或β,γ-相邻手性中心的胺是许多生物活性分子中的重要结构单元。目前,直接金属催化制备γ-手性胺的方法较少报导。Buchwald课题组开发了Cu催化的还原接力氢胺化反应。Hull课题组通过铑催化烯丙基胺的还原胺化,实现了γ支链胺的不对称合成。张万斌课题组通过铑催化烯丙基胺的不对称氢化反应来合成了γ-手性胺(图1)。而上述这些方法均只能构建一个手性中心,β, γ-手性胺的制备方法仍然缺乏。

图1 氮原子远端手性中心及构建方法
经过条件筛选,作者确定了反应最优条件,并进行了底物拓展。该反应体系能够兼容包括呋喃、硅醚、酯、OTs、溴、叠氮在内的一系列官能团,生成相应γ-及β, γ-手性胺(图2,3)。
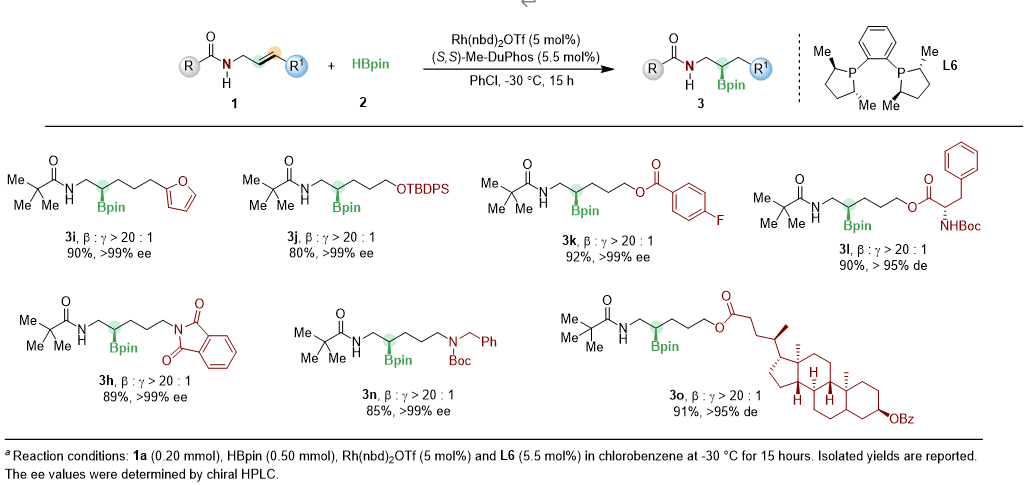
图2 部分二取代底物展示
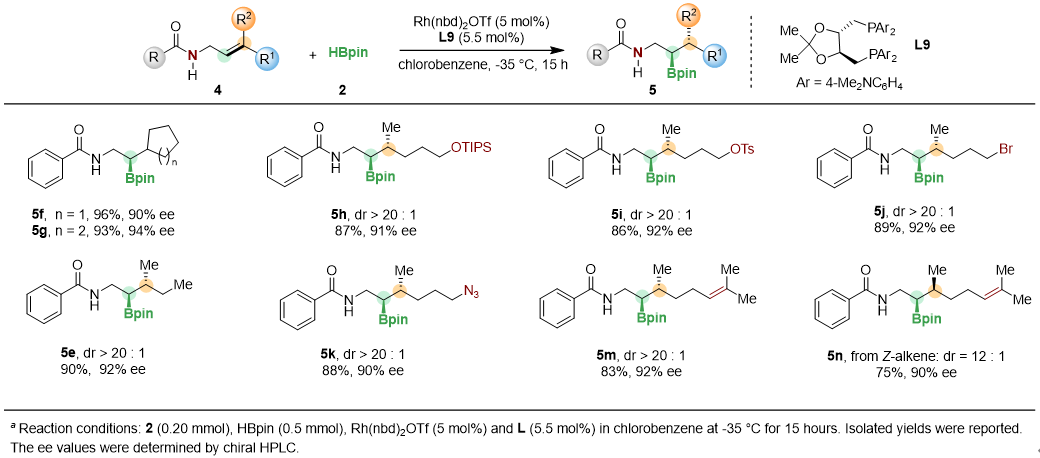
图3 部分三取代底物展示
由于其对叠氮基团的兼容性,该反应在环状手性胺的合成中也具有应用前景。利用Matteson等人报导的胺化方法,从二取代烯烃底物1p出发,经3步转化即可高效合成Remoxipride的核心骨架6e;从三取代烯烃底物4r出发可以合成得到6f,该化合物可作为食欲素受体抑制剂7b的合成前体(图4)。
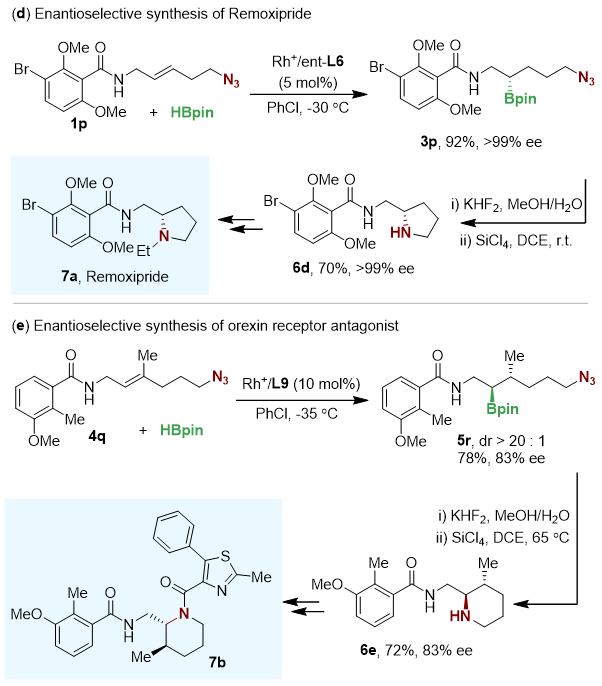
图4 分子内胺化用于合成环状手性胺
DFT计算表明,反应中Rh-H键的迁移插入是决定立体选择性的步骤。进一步分析迁移插入的过渡态结构,磷原子上取代基与底物之间的排斥是导致两种构型过渡态之间能量差异的主要原因(图5)。
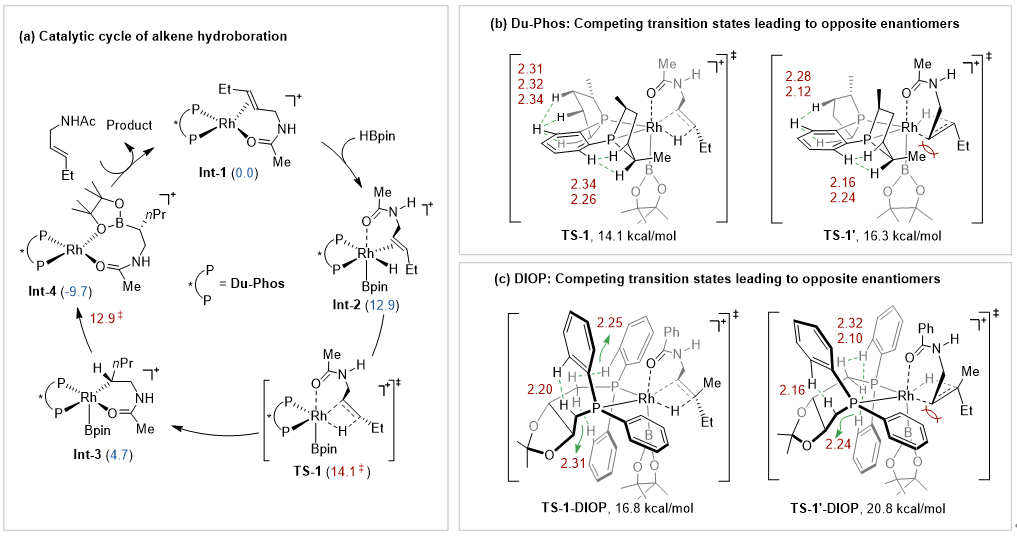
图5 DFT计算
总结:李必杰课题组开发了铑催化的酰胺导向非活化内烯烃的不对称硼氢化反应,该反应能够以高产率、高对映选择性和非对映选择性地构建β-手性胺和β、γ-手性胺类产物。该反应条件简单,易于操作,所引入的硼酸酯易于进一步衍生化,为氮原子远端手性中心的构建提供了新的思路。