铱催化α-烯烃的高支链选择性和对映选择性氢烯基化反应
近日,清华大学李必杰课题组在JACS上报道了通过导向的烯胺C-H键断解实现铱催化α-烯烃的不对称加氢烯基化反应。这种原子经济性的加成过程具有高度的支链选择性和对映选择性,可获得具有烯丙基立体中心的三取代烯烃。DFT计算揭示了区域选择性和对映选择性的起源。文章链接DOI:10.1021/jacs.2c07477
烯烃是石油化工生产中的大宗化学品,储量丰富,廉价易得。烯烃的不对称氢官能团化是原子经济性的快速构建高附加值手性分子的重要方法。其中,金属催化的芳基和烯基sp2碳氢键对α-烯烃的加成一般优先得到直链选择性的加成产物。近年来,侯召民教授、史炳锋教授、Bower、Ackermann等几个课题组先后报道了芳基碳氢键对α-烯烃的支链选择性不对称加成反应。董广彬教授课题组发展了烯胺碳氢键对α-烯烃的支链选择性加成。然而,烯基sp2碳氢键对α-烯烃的支链选择性的不对称加成反应尚未有报道。在前期研究的基础上,清华大学李必杰课题组实现了铱催化烯基酰胺sp2碳氢键对α-烯烃的支链选择性不对称加成反应,高效构建了含有烯丙位手性中心的三取代Z-式烯胺(图1)
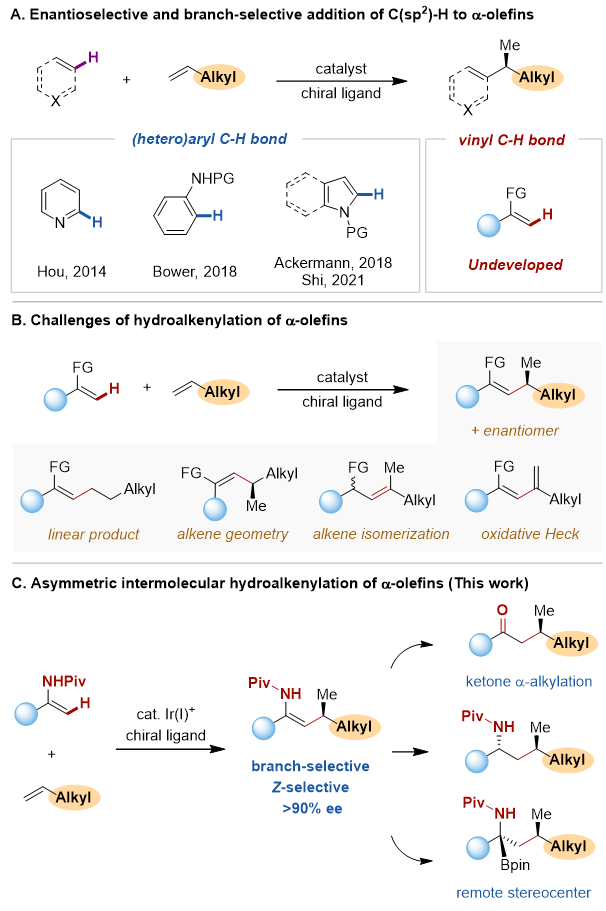
图1. α-烯烃的不对称氢烯基化
作者首先以叔丁酰基保护的烯胺1和1-辛烯2作为模板底物,对反应条件进行优化。在Ir(COD)2OTf和一系列手性配体存在下对反应进行了条件优化。研究发现,在Ir(COD)2OTf 和CTH-P-Phos的催化体系下,以邻二氯苯(o-DCB)作为溶剂,能以75%的产率和94%的ee值获得产物,其中支链选择性和Z/E比均>20:1。
在获得最优条件后,作者对反应的底物范围进行了探索。作者发现烯胺氮上的取代基对对映选择性有较大影响,其中N-叔丁酰基效果最好。使用N-叔丁酰基作为导向基团,多种 α-芳基烯胺可以高效的进行转化,其中芳基的空间和电子效应对产率和对映选择性都没有显著影响。另一方面,作者也对α-烯烃的范围进行了拓展。除了多种工业原料级的烯烃可以兼容外,反应还能兼容各种常见的官能团,例如羰基、酯、硅醚、缩醛、邻苯二甲酰亚胺、芳基醚和杂环等。带有天然产物或药物分子片段的α-烯烃也可以以高非对映选择性完成转化(图2)。
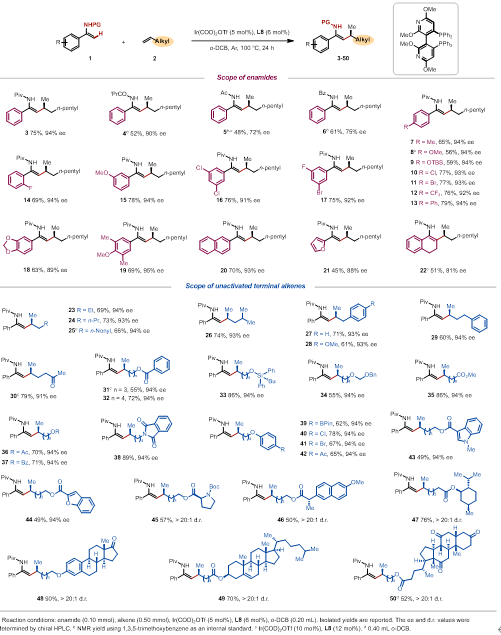
图2. 底物拓展
作者随后对产物进行了衍生化。光学纯的烯胺经水解后,可以得到β-位含有手性中心的酮,且ee值不受影响。还可以通过不对称氢化和硼氢化构建含非连续手性中心的胺类化合物(图3)。
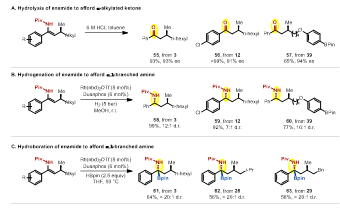
图3. 产物衍生化
接着,作者通过DFT对反应过程进行了计算,发现迁移插入是立体选择性决定步骤。通过NCI对关键过渡态进行分析,底物与配体之间的空间排斥是导致两种立体选择性过渡态(TS-2ab和TS-2bb)之间和两种区域选择性过渡态之间(TS-3ba和TS-3bb)能量差异的主要原因(图4)。
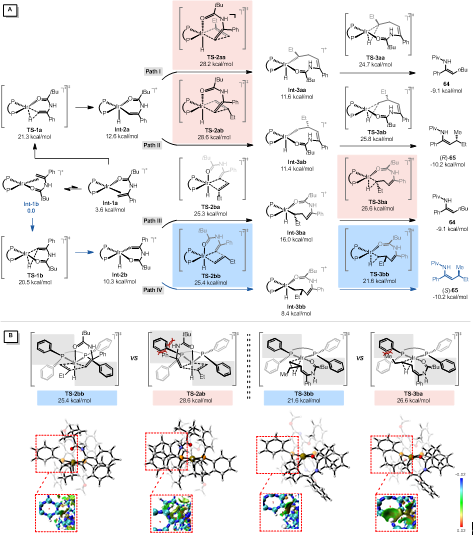
图4. DFT计算和NCI分析
最后,为了验证反应是导向的C-H键断裂机理,作者用当量的[IrCl(coe)2]2和PPh3与底物1反应,合成了氧化加成后的Ir-H络合物C1,支持了通过氧化加成使C-H键断裂的机理(图5)。
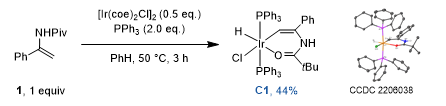
图5. 合成Ir-H络合物
李必杰课题组开发了铱催化α-烯烃的不对称氢烯基化反应,高效构建含有烯丙位手性中心的三取代Z-式烯胺。此外,光学纯的烯胺可以继续进行转化。最后,通过DFT计算和NCI分析解释了区域选择性和对映选择性的控制因素。