锆催化不对称可见光de Mayo反应
De Mayo反应是一种独特的羰基-烯烃光偶联过程,可以策略性地实现碳-碳键的形成和断裂,对化合物的化学键和分子结构进行重构。该反应于1962年由de Mayo教授发现,其可见光促进过程在近年来分别被Marzo和König小组,Guldi和Glorius小组, 以及罗三中课题组实现(图1A,左侧)。尽管该反应已经广泛应用于天然产物的全合成中,但催化不对称de Mayo反应仍然尚未实现。其中的挑战来自于在温和的条件下产生高能量的激发态物种,并在激发态环加成过程中实现立体选择性控制。
近日,清华大学化学系基础分子科学中心罗三中教授课题组利用不对称双酸催化(ABC)体系,通过具有可见光响应性的新型锆-手性磷酸(CPA)-烯醇负离子配合物中间体(图1A,右侧),首次实现了de Mayo反应的催化不对称过程,其中磷酸的使用不仅实现了有效的立体控制,而且反应速率提升为原反应的2倍左右(图1B)。该反应通过实现碳-碳键的不对称形成-断裂过程得到不常见的手性1,5-二酮,具有重构分子得到复杂手性产物的潜力。
该成果近期发表在Journal of the American Chemical Society上,清华大学博士后张文昭博士为文章的第一作者,副研究员张龙博士参与了研究工作。
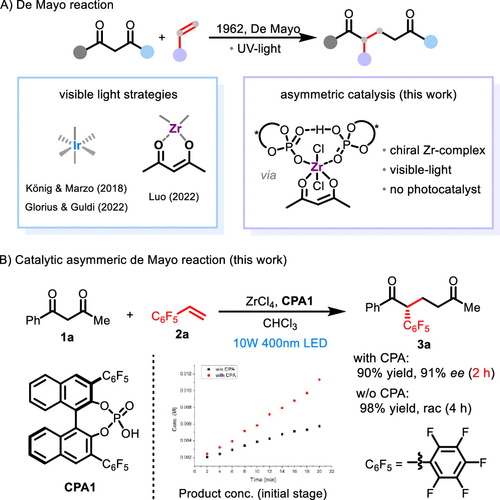
图1. 经Zr-CPA的催化不对称de Mayo反应。图片来源:J. Am. Chem. Soc
罗三中课题组多年致力于手性伯胺不对称催化体系的研究,并积极探索手性烯胺中间体与光催化、电催化等新催化方式的有机结合。通过可见光促进的方式,该课题组最早于2014年就实现了催化不对称光烷基化反应(J. Am. Chem. Soc. 2014, 136, 14642-14645),并进一步实现了无需光敏剂的过程(Chin. J. Chem. 2018, 36, 716-722)。近年来,罗三中组进一步发展了烯胺中间体的光调控策略,实现了基于光氧化的α-亚胺基自由基反应(Angew. Chem. Int. Ed. 2017, 56, 3694-3698; J. Am. Chem. Soc. 2022, 144, 10705–10710);2022年他们实现了基于烯胺光化学E/Z异构化的去消旋化(Science 2022, 375, 869-874),其中手性烯胺中间体在基态与激发态下的动力学和热力学性质对反应的进行至关重要。该课题组早先曾以de Mayo反应为设想对烯胺酮中间体在激发态下的光化学反应进行了探讨(J. Photochem. Photobiol., A. 2020, 396, 112553),虽然在光物理性质上烯胺酮的吸收相比底物二酮发生了明显红移,但是预期的de Mayo过程并没有发生而得到了[1,3]-羰基迁移的产物。在经过大量尝试后,该课题组意外发现了金属锆的光催化特性(Chem. Commun. 2022, 58, 12979-12982)。以此为契机,罗三中课题组利用手性双酸催化策略(Chem. Commun. 2013, 49, 847-858),最终成功实现了首例催化不对称de Mayo反应。
该课题组以氯化锆和手性磷酸作为催化剂,考察了不同CPA对反应的影响,最终确定含有五氟苯基的催化剂CPA1为最优催化剂,可以仅需2小时以90%的产率和91%的ee值得到具有手性的de Mayo反应产物3a,且五氟苯基对反应的立体选择性控制非常重要(图2,1-5)。增加或减少ZrCl4/CPA的比例均对反应不利,减少催化剂用量也使得反应效果下降(图2,6-8)。溶剂筛选表明氯仿为最优溶剂,稀释反应浓度或降低微微过量的烯烃用量也对反应不利(图2,9-12)。
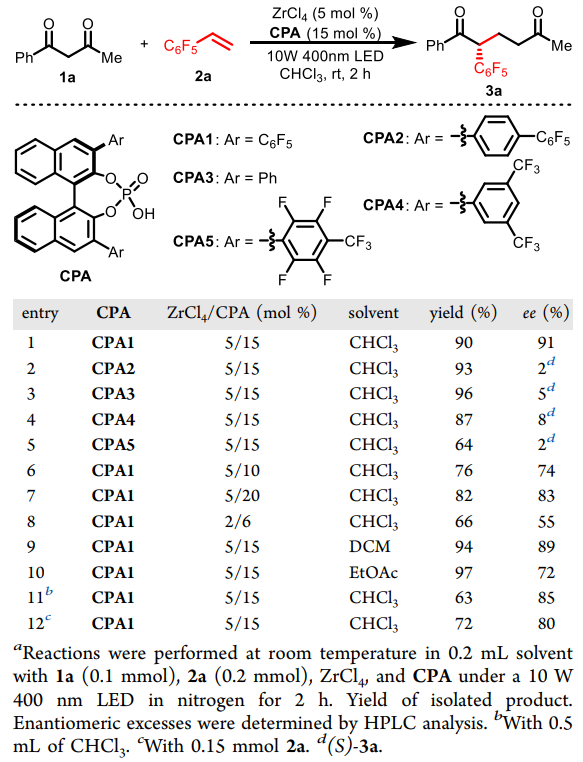
图2. 条件筛选和优化。图片来源:J. Am. Chem. Soc
该催化不对称de Mayo反应可以广泛兼容各类二酮底物,其中烷基酮部分取代基为甲基、乙基、正丙基和异丙基反应都可以顺利进行(图3,3a-3d),但是大位阻的叔丁基酮表现不佳(图3,3e)。在芳香酮部分,带有富电子取代基的芳香酮显示出极佳的活性和较好的对映选择性(图3,3f, 3g)。包括F、Cl和Br基团在内的卤素取代基都能被很好兼容(图3,3h-3m),其中Cl-和Br-取代的二酮活性极高,使得反应在半小时内即可完成(图3,3l, 3m)。取代基所在位置不同时,反应依然可以发生(图3,3n, 3o)。然而,三氟甲基取代基的底物几乎没有实现立体选择性控制,说明该反应对吸电子基团取代的底物较为不利。
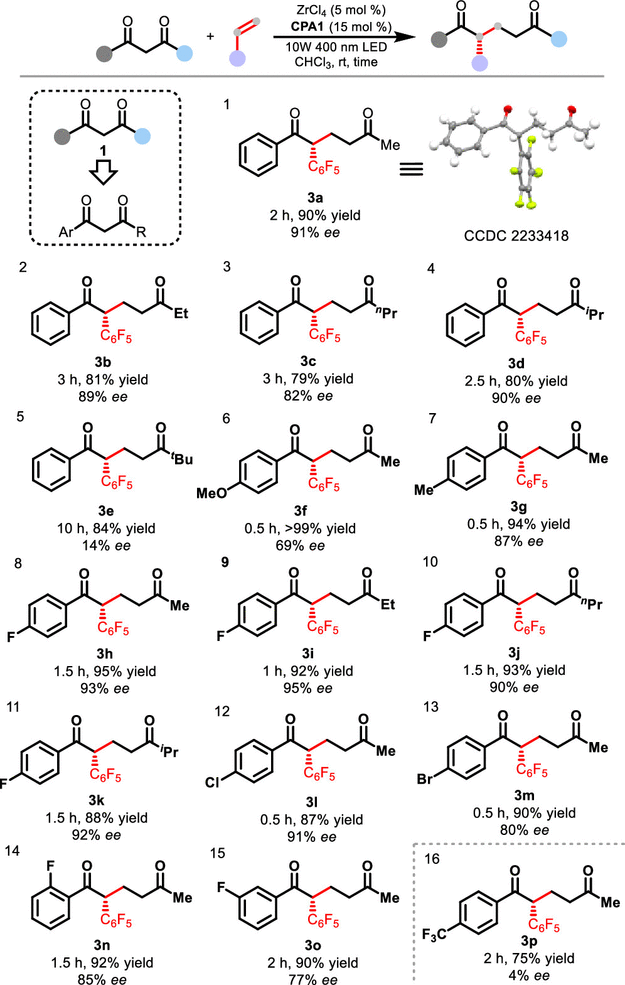
图3. 二酮的底物范围。图片来源:J. Am. Chem. Soc
该反应对不同类型烯烃也可兼容。芳香族烯烃中,带有不同取代基的的苯乙烯都可以发生(图4,3q-3v)。吸电子取代基表现出比给电子基团更高的对映选择性,例如MeO作为取代基时立体选择性相对较低(图4,3w)。1,1-二取代烯烃也可兼容于该反应,可以得到含有手性季碳中心的产物(图4,3x)。1,3-二苯基丙二酮(4a)具有两个相同的反应位点,给立体控制带来了更大的挑战,但是反应依然可以顺利进行产生相应的手性产物(图4,5a-5e)。
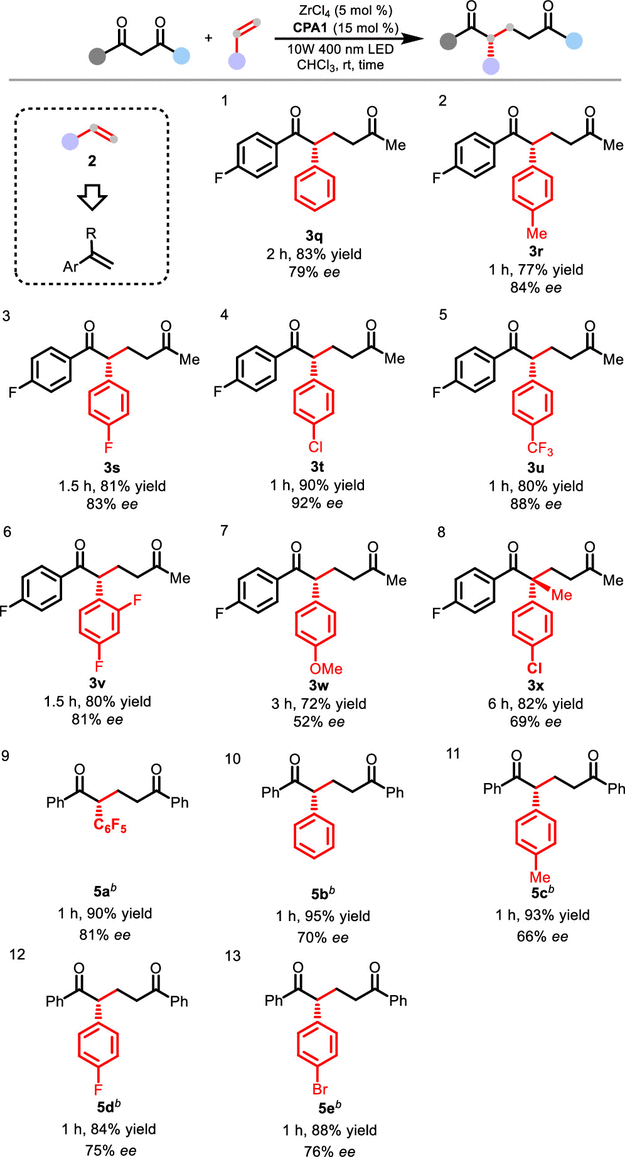
图4. 芳基烯烃的底物范围。图片来源:J. Am. Chem. Soc
脂肪族烯烃中,环己烯表现极佳,且仅需反应1小时 (图5,6a)。该转化在一步反应过程中可以以高对映选择性和非对映选择性创造两个相邻手性中心,而且兼容不同二酮(图5,6b-6g)。类似地,环戊烯也可以高效反应,但非对映选择性有所降低(图5,6h-6j)。链状烷基烯烃也显示出一定的活性,但对映选择性很低(图5,6k, 6l)。含有多个不饱和键的烯烃也可以发生反应,以中等对映选择性得到产物(图5,6m)。
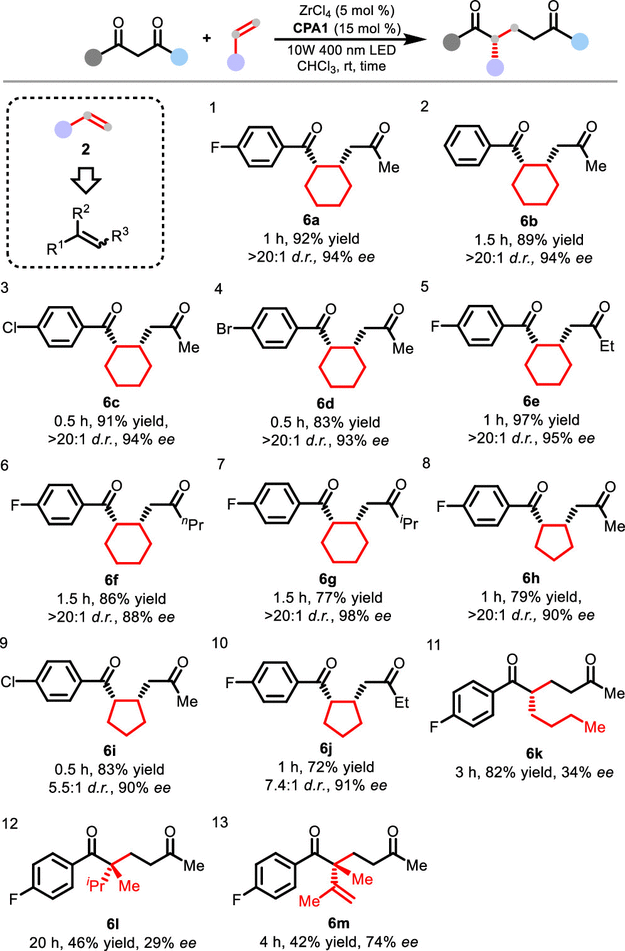
图5. 烷基烯烃的底物范围。图片来源:J. Am. Chem. Soc
克量级实验中,该反应可以在仅3 mol %负载的ZrCl4/3CPA1催化剂条件下以高达96%的收率和91%的ee值得到产物(图6A)。手性1,5-二酮产物还可以通过Aldol反应得到含有多环结构的衍生物,并且在该环化过程中分子的手性中心可以被完全保留(图6B)。
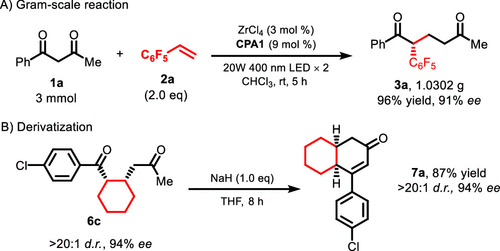
图6. 克量级实验和衍生化。图片来源:J. Am. Chem. Soc
作者通过混合ZrCl4、CPA1和4a培养出中间体复合物单晶8a(图7C),发现该手性锆配合物中含有两分子手性磷酸,两个氯原子和一个烯醇负离子,其中两个磷酸单元通过氢键连接为二齿螯合配体。该配合物表现出C2对称的手性,其中五氟苯基取代基的位阻对烯醇平面具有不对称的面屏蔽作用(图7C, 图7D)。紫外可见光谱显示,相比二酮4a,8a在410 nm处显示出新的吸收(图7A),同时反应发生的高浓度下,该吸收进一步红移至约440 nm处(图7B)。原位混合ZrCl4,CPA1和4a进行光谱测试,在不同浓度下均得到和8a几乎相同的吸收(图7A, 图7B),表明8a是溶液中的主要活性物质且具有光响应性。8a和2a在可见光照射下进行当量实验,可以以81%的产率和76%的ee值得到产物(图7E),证实了该配合物是反应的光活性中间体。
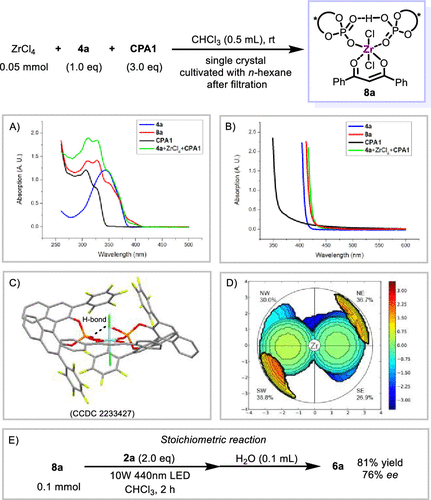
图7. 机理研究。图片来源:J. Am. Chem. Soc
作者提出的催化循环如图8所示。配合物8b可见光激发后经过[2+2]环加成反应和逆Aldol反应,再通过配体交换脱离配合物得到产物,而8b的可见光吸收特性使得无需外加光敏剂即可发生反应。光环加成过程主要发生在芳香取代烯醇结构,而非烷基烯醇共振结构8b’,可以解释该反应具有良好的区域选择性。如TS-1所示,反应的对映选择性是在三重态下的[2+2]环加成步骤中决定的,配合物的C2手性口袋在该过程中起到了关键作用,过渡态中芳香取代基和芳香烯烃之间的π-π相互作用可以解释不同电性底物反应效果的差异。
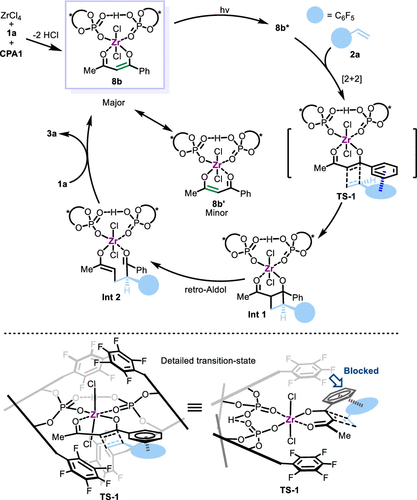
图8. 推测的催化循环和过渡态。图片来源:J. Am. Chem. Soc
总结而言,罗三中课题组发展了一种无需外加光敏剂的可见光下的手性磷酸锆催化不对称de Mayo反应。ZrCl4-CPA双酸催化剂可以促进具有可见光响应性的手性烯醇锆配合物的生成,使得二酮和烯烃发生具有区域选择性和立体选择性的de Mayo反应,以优秀的产率和对映选择性得到一系列手性1,5-二酮。